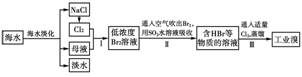
7.以下四组气体分别与对应的试纸接触,均能使试纸变蓝的是( )
|
选项 |
湿润的淀粉-KI试纸 |
湿润的红色石蕊试纸 |
|
A |
SO2 |
NH3 |
|
B |
H2S |
HCl |
|
C |
Cl2 |
CO2 |
|
D |
NO2 |
NH3 |
[解析] 能够使湿润的淀粉KI试纸变蓝的是氧化性气体,如Cl2、NO2等,能够使湿润的红色石蕊试纸变蓝的是碱性气体,如NH3,故D项正确。
[答案] D