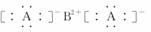18.(8分)(2010·江西省联考)短周期元素W、X、Y、Z在元素周期表中的相对位置如下表所示。其中X、Y、Z三种元素的质子数之和为21。
|
W |
|
|
|
|
|
|
|
|
|
|
|
X |
Y |
Z |
|
|
(1)W与Z可形成原子个数比为1?1的化合物,其电子式为________。
(2)Y的最高价氧化物对应的水化物与Y的氢化物恰好完全反应,生成物的水溶液呈酸性,其原因是____________________(用化学用语表示);该溶液中各种离子浓度由大到小的顺序为______________________。
(3)由XW4、Z2和KOH溶液组成的新型燃料电池中,负极上发生反应的电极反应式为________________。
(4)已知:2YZ2(g)⇌Y2Z4(g);ΔH<0。在恒温恒容条件下,将一定量YZ2和Y2Z4的混合气体通入容积为2 L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。
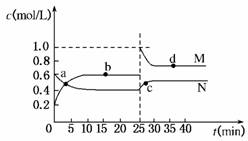
①a、b、c、d四个点中,化学反应处于平衡状态的是________点。
②25 min时,增加了________(填物质的化学式)________mol。
③a、b、c、d四个点所表示的反应体系中,气体颜色由深到浅的顺序是________(填字母)。
解析:X、Y、Z分别为ⅣA、ⅤA、ⅥA族元素,根据其质子数之和为21,可以推断X为C,Y为N,Z为O,进而推断W为H。(1)H和O形成的原子个数比为1:1的化合物为H2O2,其电子式为H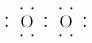 ?H。(2)N的最高价氧化物对应的水化物HNO3与其氢化物NH3恰好反应生成NH4NO3,由于NH水解,溶液显酸性。(3)CH4、O2和KOH溶液组成的燃料电池中,负极CH4发生氧化反应,电极反应式为:CH4-8e-+10OH-===CO+7H2O。(4)①图象中b、d点处于平衡状态。②根据图象,M曲线代表NO2,N曲线代表N2O4,25 min时NO2增加的物质的量为:(1.0-0.6)mol/L×2 L=0.8 mol。③NO2的体积分数越大,气体颜色越深,故气体颜色由深到浅的顺序为cdba。
?H。(2)N的最高价氧化物对应的水化物HNO3与其氢化物NH3恰好反应生成NH4NO3,由于NH水解,溶液显酸性。(3)CH4、O2和KOH溶液组成的燃料电池中,负极CH4发生氧化反应,电极反应式为:CH4-8e-+10OH-===CO+7H2O。(4)①图象中b、d点处于平衡状态。②根据图象,M曲线代表NO2,N曲线代表N2O4,25 min时NO2增加的物质的量为:(1.0-0.6)mol/L×2 L=0.8 mol。③NO2的体积分数越大,气体颜色越深,故气体颜色由深到浅的顺序为cdba。
答案:(1)H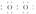 H (2)NH+H2ONH3·H2O+H+ c(NO)>c(NH)>c(H+)>c(OH-) (3)CH4-8e-+10OH-===CO+7H2O (4)①b、d ②NO2 0.8 ③cdba
H (2)NH+H2ONH3·H2O+H+ c(NO)>c(NH)>c(H+)>c(OH-) (3)CH4-8e-+10OH-===CO+7H2O (4)①b、d ②NO2 0.8 ③cdba
17.(8分)(2010·福建卷)J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如下表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素。
|
|
J |
|
|
|
|
|
|
|
R |
|
(1)M的离子结构示意图为________;元素T在周期表中位于第________族。
(2)J和氢组成的化合物分子有6个原子,其结构简式为________。
(3)M和T形成的化合物在潮湿的空气中冒白色烟雾,反应的化学方程式为________________________。
(4)L的最简单气态氢化物甲的水溶液显碱性。
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为______________________。
②一定条件下,甲在固定体积的密闭容器中发生分解反应(ΔH>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是________(选填序号)。
|
选项 |
a |
b |
c |
d |
|
x |
温度 |
温度 |
加入H2的 物质的量 |
加入甲的 物质的量 |
|
y |
甲的物 质的量 |
平衡常 数K |
甲的转化率 |
生成物物质 的量总和 |
(5)由J、R形成的液态化合物JR2 0.2 mol在O2中完全燃烧,生成两种气态氧化物,298 K时放出热量215 kJ。该反应的热化学方程式为______________________。
解析:本题考查元素的推断,意在考查考生的分析推断能力。根据J元素最低负化合价的绝对值与其原子最外层电子数相等,则J的最低负价为-4价,位于ⅣA族,又五种元素均为短周期主族元素,则J为C,R为S,T的原子序数比R大,则T只能为Cl;根据M是地壳中含量最多的金属元素,则M为Al。(1)Al3+的结构示意图为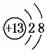 ,Cl位于元素周期表第ⅦA族。(2)C和H组成的含6个原子的化合物为乙烯,其结构简式为CH2===CH2。(3)Al和Cl形成的化合物为AlCl3,在潮湿的空气中发生水解反应,产生白色烟雾。(4)L的最简单气态氢化物甲的溶液显碱性,则L为N,甲为NH3。①结合提供信息,可以推断NH3和H2O2反应生成N2和H2O。②对于平衡:2NH3N2+3H2,升高温度,平衡向正方向移动,则n(NH3)减小,a对;升高温度,平衡向正方向移动,c(NH3)减小,c(N2)和c(H2)均增大,则平衡常数增大,b错;加入H2,c(H2)增大,平衡向逆方向移动,NH3的转化率减小,c对;加入NH3,平衡向正方向移动,生成物物质的量总和增大,d错。
,Cl位于元素周期表第ⅦA族。(2)C和H组成的含6个原子的化合物为乙烯,其结构简式为CH2===CH2。(3)Al和Cl形成的化合物为AlCl3,在潮湿的空气中发生水解反应,产生白色烟雾。(4)L的最简单气态氢化物甲的溶液显碱性,则L为N,甲为NH3。①结合提供信息,可以推断NH3和H2O2反应生成N2和H2O。②对于平衡:2NH3N2+3H2,升高温度,平衡向正方向移动,则n(NH3)减小,a对;升高温度,平衡向正方向移动,c(NH3)减小,c(N2)和c(H2)均增大,则平衡常数增大,b错;加入H2,c(H2)增大,平衡向逆方向移动,NH3的转化率减小,c对;加入NH3,平衡向正方向移动,生成物物质的量总和增大,d错。
答案:(1)  ⅦA (2)CH2=CH2
ⅦA (2)CH2=CH2
(3)AlCl3+3H2O===Al(OH)3+3HCl↑
(4)①2NH3·H2O+3H2O2===N2↑+8H2O
或2NH3+3H2O2===N2↑+6H2O
②ac
(5)CS2(l)+O2(g)===CO2(g)+SO2(g)
ΔH=-215 kJ·mol-1