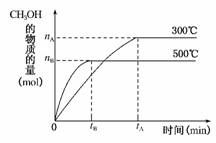
11.已知某反应A(g)+B(g)⇌C(g)+D(g)进行过程中的能量变化如图所示,请回答下列问题:
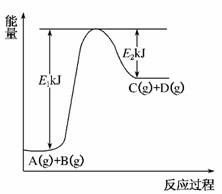
(1)该反应的ΔH=________kJ·mol-1(用含E1、E2的代数式表示)。,(2)若在反应体系中加入催化剂使逆反应速率增大,则E1________(填“增大”、“减小”或“不变”,下同),ΔH________。,(3)在相同温度和压强下,对反应A(g)+B(g)C(g)+D(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表:
,
|
|
A |
B |
C |
D |
|
甲 |
a mol |
a mol |
0 |
0 |
|
乙 |
2a mol |
a mol |
0 |
0 |
|
丙 |
a mol |
a mol |
a mol |
a mol |
|
丁 |
a mol |
0 |
a mol |
a mol |
上述四种情况达到平衡后,n(C)的大小顺序是________。
A.乙=丁>丙=甲 B.乙>丁>甲>丙
C.丁>乙>丙=甲 D.丁>丙>乙>甲
(4)若上述反应达到平衡,为了提高A的转化率,可以采用的措施有(写一条):________________________________________________________________________。
(5)在恒温恒容条件下进行上述反应。下列情况可以判断该反应达到平衡状态的是________。
A.气体平均摩尔质量不再变化
B. 气体压强不再变化
C. 气体密度不再变化
D. 消耗A的速率等于消耗D的速率
E. 各组分浓度之比为1:1:1:1
F. C生成的速率等于B消耗的速率
解析:(2)使用催化剂可以降低反应所需要的能量,但不影响反应的反应热;(3)依题意,四组实验中,温度、压强相等,容器的容积不一定相等。采用“一边倒”法,将产物转化成起始反应物,列表如下:,
|
|
A |
B |
C |
D |
|
甲 |
a
mol |
a
mol |
0 |
0 |
|
乙 |
2a
mol |
a
mol |
0 |
0 |
|
丙 |
2a
mol |
2a
mol |
0 |
0 |
|
丁 |
2a mol |
a
mol |
0 |
0 |
等温等压下,起始物质投料物质的量(物质的量浓度)之比相同,达到同一平衡状态。根据表格数据知,甲和丙达到同一平均状态;乙和丁达到同一平衡状态。乙平衡状态,可以看成甲达到平衡后,向体系中增大A的浓度,平衡向右移动,C浓度增大。所以,达到平衡时,C的物质的量:乙=丁>甲=丙。
答案:(1)E1-E2 (2)减小 不变 (3)A (4)升高温度、增加B的浓度 (5)D
9.在相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)⇌2NH3(g);ΔH=-92.6 kJ/mol,实验测得起始与平衡时有关数据如下表所示:,
|
实验编号 |
起始时各物质的量/mol |
达到平衡时体系 能量的变化 |
||
|
N2 |
H2 |
NH3 |
||
|
① |
1 |
3 |
0 |
23.15
kJ |
|
② |
0.9 |
2.7 |
0.2 |
Q |
下列叙述错误的是( )
A.达到平衡时两容器中压强相同
B.平衡时两容器内NH3的体积分数均为
C.平均时容器②中Q=23.15 kJ
D.若容器①的容积为0.5 L,则平衡时放出的热量小于23.15 kJ
解析:将容器②中NH3的量转化为N2、H2后知,两个容器中相同的物质起始量相同,故它们可构成恒容条件下的等效平衡,平衡时两容器内各物质的量对应相等,A对;但通过反应生成NH3的量容器②的比①的少,故②中反应放出的热量少于23.15 kJ,C错;当容器容积扩大时,相当于减小压强,平衡向左移动,放出的热量减少,D对;由热化学方程式及平衡时放出的热量数值知,平衡时生成了0.5 mol NH3,混合气体共为3.5 mol,故B对。
答案:C