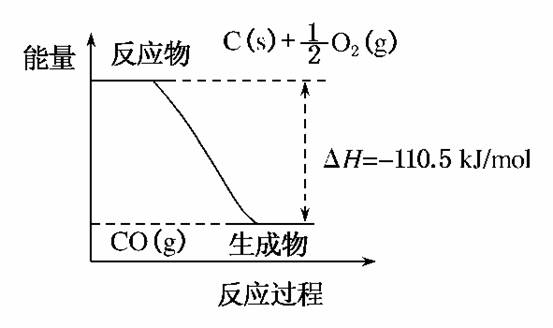
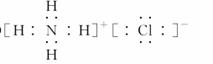4.(2010·邯郸市摸底考试)一些烷烃的燃烧热如下表:
|
化合物 |
燃烧热/kJ·mol-1 |
化合物 |
燃烧热/kJ·mol-1 |
|
甲烷 |
890.3 |
正丁烷 |
2878.0 |
|
乙烷 |
1560.8 |
异丁烷 |
2869.6 |
|
丙烷 |
2221.5 |
2-甲基丁烷 |
3531.3 |
下列表达正确的是( )
A.乙烷燃烧的热化学方程式为:2C2H6(g)+7O2(g)===4CO2(g)+6H2O(g);ΔH=-1560.8 kJ·mol-1
B.稳定性:正丁烷>异丁烷
C.正戊烷的燃烧热大于3531.3 kJ·mol-1
D.相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多
解析:选项A,所给的热化学方程式中H2O为非稳定的气态,且ΔH值也与化学计量数不符,错误。选项B,等物质的量的正丁烷燃烧释放出的热量大于异丁烷,说明正丁烷具有的总能量大于异丁烷,能量越高越不稳定,所以异丁烷的稳定性大于正丁烷。选项C,根据正丁烷的燃烧热大于异丁烷,推知正戊烷的燃烧热大于2甲基丁烷的燃烧热,即正戊烷的燃烧热大于3531.5 kJ·mol-1。选项D,相同质量的烷烃,氢的质量分数越大,燃烧放出的热量越多。
答案:C
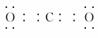 ,属于非极性分子。(3)在加热的条件下,碳与浓硝酸发生氧化还原反应,生成二氧化碳、二氧化氮和水。(4)O与C、N、P形成的原子个数比为1?2的化合物有CO2、NO2、N2O、N2O4,其中NO2的价电子总数为奇数,不符合题意。
,属于非极性分子。(3)在加热的条件下,碳与浓硝酸发生氧化还原反应,生成二氧化碳、二氧化氮和水。(4)O与C、N、P形成的原子个数比为1?2的化合物有CO2、NO2、N2O、N2O4,其中NO2的价电子总数为奇数,不符合题意。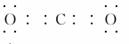 非极性分子
非极性分子
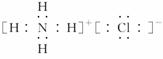 。(3)所有气态氢化物中最稳定的是HF,则元素F的单质与水反应的化学方程式为:2F2+2H2O===4HF+O2。(4)检验二氧化碳气体常用澄清石灰水,则金属元素丙为Ca,它的离子半径与Cl-半径比较时,根据相同电子层结构的离子,原子序数越大,离子半径越小,则为r(Ca2+)<r(Cl-);元素丁的原子序数比丙小8,则为Mg元素,它的单质在二氧化碳中燃烧的化学方程式为:2Mg+CO22MgO+C。(5)戊是第三周期中简单离子半径最小的元素,则为Al元素,它的最高价氧化物对应的水化物是Al(OH)3,它存在酸式电离和碱式电离,则电离方程式为:Al3++3OH-
。(3)所有气态氢化物中最稳定的是HF,则元素F的单质与水反应的化学方程式为:2F2+2H2O===4HF+O2。(4)检验二氧化碳气体常用澄清石灰水,则金属元素丙为Ca,它的离子半径与Cl-半径比较时,根据相同电子层结构的离子,原子序数越大,离子半径越小,则为r(Ca2+)<r(Cl-);元素丁的原子序数比丙小8,则为Mg元素,它的单质在二氧化碳中燃烧的化学方程式为:2Mg+CO22MgO+C。(5)戊是第三周期中简单离子半径最小的元素,则为Al元素,它的最高价氧化物对应的水化物是Al(OH)3,它存在酸式电离和碱式电离,则电离方程式为:Al3++3OH- Al(OH)3
Al(OH)3