网址:http://m.1010jiajiao.com/timu3_id_85265[举报]
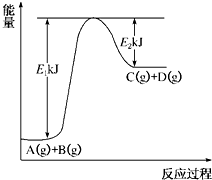 已知某反应A(g)+B(g)?C(g)+D(g)进行过程中的能量变化如图所示,请回答下列问题:
已知某反应A(g)+B(g)?C(g)+D(g)进行过程中的能量变化如图所示,请回答下列问题:(1)该反应的△H=
(2)若在反应体系中加入催化剂使逆反应速率增大,则E1
(3)在相同温度和压强下,对反应A(g)+B(g)?C(g)+D(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表:
| A | B | C | D | |
| 甲 | a mol | a mol | 0 | 0 |
| 乙 | 2a mol | a mol | 0 | 0 |
| 丙 | a mol | a mol | a mol | a mol |
| 丁 | a mol | 0 | a mol | a mol |
A.甲=丙>乙=丁 B.乙>丁>甲>丙 C.丁>乙>甲=丙 D.丙>乙=丁>甲
(4)若上述反应达到平衡,为了提高A的转化率,可以采用的措施有(写一条):
(5)在恒温恒容条件下进行上述反应.下列情况可以判断该反应达到平衡状态的是
A.气体平均摩尔质量不再变化 B.气体压强不再变化
C.气体密度不再变化 D.消耗A的速率等于消耗D的速率
E.各组分浓度之比为1:1:1:1 F.C生成的速率等于B消耗的速率.
 已知某反应A(g)+B(g)?C(g)+D(g) 过程中的能量变化如图所示,回答下列问题.
已知某反应A(g)+B(g)?C(g)+D(g) 过程中的能量变化如图所示,回答下列问题.(1)该反应是
(2)若在反应体系中加入催化剂使逆反应速率增大,则E1和E2的变化是:E1
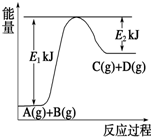 Ⅰ.已知某反应A(g)+B(g)?C(g)+D(g),过程中的能量变化如图所示,回答下列问题.
Ⅰ.已知某反应A(g)+B(g)?C(g)+D(g),过程中的能量变化如图所示,回答下列问题.(1)该反应是
(2)若在反应体系中加入催化剂使逆反应速率增大,则E1和E2的变化是:E1
Ⅱ.已知下列热化学方程式
Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H1=-25kJ?mol-1①
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H2=-47kJ?mol-1 ②
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H3=+19kJ?mol-1③
写出FeO(s)被CO还原成Fe和CO2的热化学方程式
(8分) 已知某反应A(g)+B(g)?C(g)+D(g)进行过程中的能量变化如图所示,请回答下列问题:
(1)该反应的ΔH=________kJ·mol-1(用含E1、E2的代数式表示)。(1分)
(2)若在反应体系中加入催化剂使逆反应速率增大,则E1________(填“增大”、“减小”或“不变”,下同),ΔH________。(2分)
(3)在相同温度和压强下,对反应A(g)+B(g)??C(g)+D(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表:
| | A | B | C | D |
| 甲 | a mol | a mol | 0 | 0 |
| 乙 | 2a mol | a mol | 0 | 0 |
| 丙 | a mol | a mol | a mol | a mol |
| 丁 | a mol | 0 | a mol | a mol |
A.乙=丁>丙=甲 B.乙>丁>甲>丙 C.丁>乙>丙=甲 D.丁>丙>乙>甲
(4)若上述反应达到平衡,为了提高A的转化率,可以采用的措施有(写一条):________________________________________________________________________。(1分)
(5)在恒温恒容条件下进行上述反应。下列情况可以判断该反应达到平衡状态的是____(2分)
A.气体平均摩尔质量不再变化 B. 气体压强不再变化
C. 气体密度不再变化 D. 消耗A的速率等于消耗D的速率
E. 各组分浓度之比为1:1:1:1 F. C生成的速率等于B消耗的速率 查看习题详情和答案>>
(8分) 已知某反应A(g)+B(g)⇌C(g)+D(g)进行过程中的能量变化如图所示,请回答下列问题:
(1)该反应的ΔH=________kJ·mol-1(用含E1、E2的代数式表示)。(1分)
(2)若在反应体系中加入催化剂使逆反应速率增大,则E1________(填“增大”、“减小”或“不变”,下同),ΔH________。(2分)
(3)在相同温度和压强下,对反应A(g)+B(g)??C(g)+D(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表:
|
| A | B | C | D |
| 甲 | a mol | a mol | 0 | 0 |
| 乙 | 2a mol | a mol | 0 | 0 |
| 丙 | a mol | a mol | a mol | a mol |
| 丁 | a mol | 0 | a mol | a mol |
上述四种情况达到平衡后,C(D)的大小顺序是________。(2分)
A.乙=丁>丙=甲 B.乙>丁>甲>丙 C.丁>乙>丙=甲 D.丁>丙>乙>甲
(4)若上述反应达到平衡,为了提高A的转化率,可以采用的措施有(写一条):________________________________________________________________________。(1分)
(5)在恒温恒容条件下进行上述反应。下列情况可以判断该反应达到平衡状态的是____(2分)
A.气体平均摩尔质量不再变化 B. 气体压强不再变化
C. 气体密度不再变化 D. 消耗A的速率等于消耗D的速率
E. 各组分浓度之比为1:1:1:1 F. C生成的速率等于B消耗的速率
查看习题详情和答案>>