摘要:(2010·北京市东城区检测)一定条件下.在体积为3L的密闭容器中反应CO(g)+2H2(g)⇌CH3OH(g)达到化学平衡状态. (1)500℃时.从反应开始到达到化学平衡状态.以H2的浓度变化表示的化学反应速率是 (用nB.tB表示). (2)判断该可逆反应达到化学平衡状态的标志是 .,a.v生成(CH3OH)=v消耗(CO),b.混合气体的密度不再改变,c.混合气体的平均相对分子质量不再改变,d.CO.H2.CH3OH的浓度均不再变化 (3)300℃时.将容器的容积压缩到原来的1/2.在其他条件不变的情况下.对平衡体系产生的影响是 .,a.c(H2)减小,b.正反应速率加快.逆反应速率减慢,c.CH3OH的物质的量增加,d.重新达到平衡时.c(H2)/c(CH3OH)减小 解析:(1)0-tB时间内.生成nB mol CH3OH.则消耗2nB mol H2.则Δc(H2)=2nB/3 mol/L.v(H2)=2nB/(3tB)mol·L-1·min-1.,(2)选项a.任何时刻都有v生成(CH3OH)=v消耗(CO).选项b.因混合气体的体积不变.混合气体的质量不变.任何时刻混合气体的密度都保持不变.选项c.根据=.m气体总不变.不变.说明n气体总不变.所以反应达到了平衡状态.选项d.各种物质的浓度不变.也说明了反应已达到平衡状态.,(3)压缩容器容积相当于增大体系压强.则平衡向着正反应方向移动.正.逆反应速率都增大.但由于容积缩小为原平衡的.达新平衡时c(H2)比原平衡时的大.由于平衡向正反应方向移动.重新达到平衡时c(H2)/c(CH3OH)减小.所以选项a.b错误.c.d正确. 答案:(1)mol·L-1·min-1 cd
网址:http://m.1010jiajiao.com/timu3_id_85266[举报]
 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g).根据题意完成下列问题:
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g).根据题意完成下列问题:(1)反应达到平衡时,平衡常数表达式K=
| c(CH3OH) |
| c(CO)?C 2(H2) |
| c(CH3OH) |
| c(CO)?C 2(H2) |
减小
减小
(填“增大”、“减小”或“不变”),平衡向逆反应
逆反应
方向移动.(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=
| 2nB |
| 3tB |
| 2nB |
| 3tB |
(3)在其他条件不变的情况下,将处于E点的体系体积压缩到原来的
| 1 |
| 2 |
BC
BC
(选填选项字母).A.氢气的浓度减少
B.正反应速率加快,逆反应速率也加快
C.甲醇的物质的量增加
D.重新平衡时
| n(H2) |
| n(CH3OH) |
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是
Cu2O+CO 2Cu+CO2
2Cu+CO2
 2Cu+CO2
2Cu+CO2Cu2O+CO 2Cu+CO2
2Cu+CO2
(用化学方程式表示). 2Cu+CO2
2Cu+CO2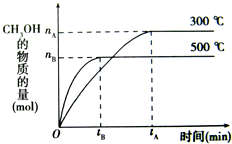 一定条件下,在体积为3L的密闭容器中化学反应CO(g)+2H2(g)-CH3OH(g)达到平衡状态.
一定条件下,在体积为3L的密闭容器中化学反应CO(g)+2H2(g)-CH3OH(g)达到平衡状态.(1)该反应的平衡常数表达式K=
| c(CH3OH) |
| c(CO)×c2(H2) |
| c(CH3OH) |
| c(CO)×c2(H2) |
增大
增大
(填“增大”、“减小”或“不变”.(2)500℃时,从反应开始到达到平衡状态,以CO的浓度变化表示的化学反应速率是v(CO)=
| nB |
| 3tB |
| nB |
| 3tB |
(3)判断可逆反应达到平衡状态的标志是
cd
cd
(填字母).a.v生成(CH3OH)=v消耗(CO) b.混合气体的密度不再改变
c.容器内气体的压强保持不变 d.CO、H2、CH3OH的浓度不再改变
(4)300℃时,将容器的体积增大1倍,在其他条件不变的情况下,对平衡体系产生的影响是
cd
cd
(填字母).a.c(H2)增大 b.正反应速率减慢,逆反应速率加快
c.CH3OH的物质的量减小 d.重新平衡时c(H2)/c(CH3OH)增大.
 (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示(2)一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反
应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g)
根据题意完成下列各题:
①反应达到平衡时,平衡常数
②表达式K=
升高温度,K值
②在500℃,从反应开始到平衡,氢气的平均反应速率v (H2)=
③据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:
 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g)
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g)根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K=
| c(CH3OH) |
| c(CO)?c2(H2) |
| c(CH3OH) |
| c(CO)?c2(H2) |
升高温度,K值
减小
减小
(填“增大”、“减小”或“不变”).(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=
| 2nB |
| 3tB |
| 2nB |
| 3tB |
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的
| 1 |
| 2 |
bc
bc
a.氢气的浓度减少 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时n(H2)/n(CH3OH)增大.
 (2011?巢湖二模)一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇的反应(催化剂为Cu2O/ZnO):CO(g)+2H2(g)
(2011?巢湖二模)一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇的反应(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g),结合右图判断下列说法正确的是( )
CH3OH(g),结合右图判断下列说法正确的是( )