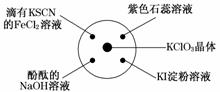
(二)猜想:可能含有Fe3+
丙:在加热除去NO2的工业硝酸中加入KSCN溶液 溶液呈红色
(1)4NO2+O2+2H2O===4HNO3
(2)加水将工业硝酸稀释,若有其他杂质颜色也可能变浅接近无色
(二)[提出问题] 上述实验后,溶液还是浅黄色,它还含有什么物质呢?乙、丙两同学提出如下猜想.
[猜想] ____________________.
[设计实验]
|
|
实验步骤 |
现象 |
结论 |
|
乙 |
在除去NO2的工业硝酸中,缓缓加入足量NaOH固体 |
红褐色沉淀生成 |
猜想正确 |
|
丙 |
|
|
[交流讨论]
(1)在(一)中,丙同学实验的原理是:__________________(用化学方程式表示).
(2)甲同学实验得出错误结论的原因可能是_____________________________________
________________________________________________________________________.
解析:在(一)中,甲同学的结论不正确.因为加水将工业硝酸稀释,若含有其他杂质颜色也可能变浅甚至接近无色.乙同学操作后,有红棕色气体逸出,同时溶液颜色变浅,说明NO2溶于硝酸中,但颜色不能完全消失,说明硝酸中还含有其他杂质,呈黄色可猜想为Fe3+.在(二)中,乙同学操作后有红褐色沉淀生成,证明工业硝酸中含有Fe3+,检验Fe3+用KSCN溶液.
答案:(一)呈黄色的工业硝酸中存在NO2气体,但还有其他呈黄色的杂质
(一)[猜想] 工业硝酸呈黄色是由于NO2溶于浓硝酸引起的.
[设计实验] 甲、乙、丙三位同学各在一支洁净试管中倒入约2 mL工业硝酸,进行如下实验:
|
|
实验步骤 |
现象 |
结论 |
|
甲 |
加入5 mL的蒸馏水,振荡使之充分混合 |
试管中的硝酸接近于无色 |
硝酸中没有其他杂质,猜想正确 |
|
乙 |
置于酒精灯上小火加热(在通风橱中进行) |
有红棕色气体逸出,继续加热,直到不再有红棕色气体逸出为止.溶液的黄色变浅,但不能完全消失 |
|
|
丙 |
通入氧气 |
通入足量氧气后,溶液的黄色变浅 |

 [Ag(NH3)2]OH或[Ag(NH3)2]NO3.
[Ag(NH3)2]OH或[Ag(NH3)2]NO3.

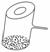 实验室里常见到如图所示的仪器,该仪器为两头密封的玻璃管,中间带有一根玻璃短柄.当玻璃管内装有碘片时,用此仪器进行碘的升华实验,具有装置简单、操作方便、现象明显、可反复使用等优点.用此仪器不能反复进行的实验是( )
实验室里常见到如图所示的仪器,该仪器为两头密封的玻璃管,中间带有一根玻璃短柄.当玻璃管内装有碘片时,用此仪器进行碘的升华实验,具有装置简单、操作方便、现象明显、可反复使用等优点.用此仪器不能反复进行的实验是( )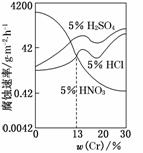 (2010·安徽高考)如图是三种稀酸对FeCr合金随Cr含量变化的腐蚀性实验结果,下列有关说法正确的是( )
(2010·安徽高考)如图是三种稀酸对FeCr合金随Cr含量变化的腐蚀性实验结果,下列有关说法正确的是( ) 稀硝酸与铁反应产生的是NO,不是NO2,B不正确;从图中曲线的走势来看,腐蚀速率与溶液中H+的浓度关系并不大(因为各种情况下H+的浓度是一定的),主要还是取决于Cr的含量.
稀硝酸与铁反应产生的是NO,不是NO2,B不正确;从图中曲线的走势来看,腐蚀速率与溶液中H+的浓度关系并不大(因为各种情况下H+的浓度是一定的),主要还是取决于Cr的含量.