网址:http://m.1010jiajiao.com/timu3_id_85051[举报]
①取100mL牛奶,加入足量的草酸铵[(NH4)2C2O4]溶液,使牛奶中的钙转化成难溶的CaC2O4沉淀;
②过滤,用适量的蒸馏水洗涤沉淀表面吸附的少量(NH4)2C2O4、蛋白质等杂质;
③将沉淀转移至锥形瓶中,加足量的稀硫酸溶液溶解CaC2O4;
④然后以0.10mol?L-1的KMnO4溶液滴定生成的H2C2O4溶液,共消耗12.00mLKMnO4溶液.
发生的反应为:
(1)配平上述方程式
(2)KMnO4溶液应盛在
(3)若滴定管的规格为25mL,滴定前滴定管中液面的读数为5.20mL,则滴定管中液体的体积为
A.5.20mL B.19.80mL C.大于19.80mL D.小于19.80mL
(4)本实验是否需要外加指示剂?
(5)滴定时边滴边摇动锥形瓶,眼睛应观察
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
(6)该牛奶中钙的含量为
某课外兴趣小组测定某品牌牛奶中钙的含量,方法如下:取100mL牛奶,加入足量的草酸铵[(NH4)2C2O4]溶液,使牛奶中的钙转化成难溶的CaC2O4沉淀;过滤,用适量的蒸馏水洗涤沉淀表面吸附的少量(NH4)2C2O4、蛋白质等杂质;将沉淀转移至锥形瓶中,加足量的稀硫酸溶液溶解CaC2O4;然后以0.10mol?L-1的KMnO4溶液滴定生成的H2C2O4溶液,共消耗12.00mLKMnO4溶液。发生的反应为:
5H2C2O4+2KMnO4+3H2SO4 = 5CO2↑+2MnSO4+K2SO4+8H2O
(1)KMnO4溶液应盛在_________(填“酸式”或“碱式”)滴定管中。
(2)若滴定管的规格为25mL,滴定前滴定管中液面的读数为5.20 mL,则滴定管中液体的体积为______(填代号)。
A.5.20 mL B.19.80 mL C.大于19.80 mL D.小于19.80 mL
(3)本实验是否需要外加指示剂? (填“是”或者“否”)。到达滴定终点时,溶液的颜色由 色变为 色。
(4)滴定时边滴边摇动锥形瓶,眼睛应观察
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
(5)该牛奶中钙的含量为_________mg/100mL。
(6)下列操作会使实验结果偏低的是____________(填代号)。
A.滴定管未用KMnO4溶液润洗就直接盛装KMnO4溶液
B.向锥形瓶转移沉淀时,损失部分沉淀
C.开始时平视读数,滴定完成时俯视读数
D.CaC2O4的表面没有洗涤干净,吸附少量C2O42-等杂质
查看习题详情和答案>>取100mL牛奶,加入足量的草酸铵[(NH4)2C2O4]溶液,使牛奶中的钙转化成难溶的CaC2O4沉淀;过滤,用适量的蒸馏水洗涤沉淀表面吸附的少量(NH4)2C2O4、 蛋白质等杂质;将沉淀转移至锥形瓶中,加足量的稀硫酸溶液溶解CaC2O4;然后以0.10mol·L-1的KMnO4 溶液滴定生成的H2C2O4溶液,共消耗12. 00mL
KMnO4溶液。发生的反应为:
5H2C2O4+2KMnO4+ 3H2SO4==10CO2↑+2MnSO4 +K2SO4 +8H2O。
问:该牛奶中钙的含量为多少mg/100mL?
| |||||||||||||||||||||||||||||||||
①称量ag样品,置于烧杯中,
②加入适量的蒸馏水,使样品溶解,然后准确配制成250mL溶液
③准确量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,加热使反应完全
④趁热迅速加入过量氨水,充分搅拌,使沉淀完全
⑤过滤,洗涤沉淀
⑥将沉淀声称到坩埚内加热,搅拌直到固体全部由红褐色变为红棕色后在干燥器中冷却到室温后,称量
⑦…根据上面叙述,回答
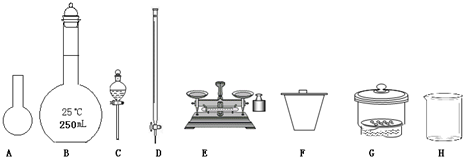
(1)如图所示仪器中,本实验步骤①②中必须用到的仪器是
(2)写出步骤③和④中发生反应的离子方程式
(3)洗涤是洗去附着在沉淀上的
(4)若坩埚质量是W1,坩埚与加热后固体总质量是W2,则样品中铁元素的质量分数为
| (w2-w1)×112×10 |
| 160a |
| (w2-w1)×112×10 |
| 160a |
(5)该兴趣小组中甲学生认为:实验步骤中不加氨水,其余步骤不变,仍可达到实验目的,你认为甲学的观点是否正确