(二)(1)2NO+O2===2NO2;3NO2+H2O===2HNO3+NO
(2)Ⅰ.V/3 mL Ⅱ.5V/4 mL、3V/8 mL
18.(10分)(2010·江西省联考)为了探究Cl2、SO2同时通入H2O中发生的反应,某校化学兴趣小组同学设计了如下图所示的实验装置。
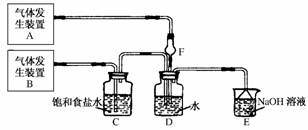
(1)气体发生装置A产生的气体是________。
(2)为验证通入D装置中的气体是Cl2过量还是SO2过量,某小组同学准备了以下试剂:
①氯化铁溶液 ②氯化亚铁溶液 ③硫氰化钾溶液
④苯酚溶液 ⑤品红溶液 ⑥酸性高锰酸钾溶液
Ⅰ.若Cl2过量:取适量D中溶液滴加至盛有____________(选填一个序号)试剂的试管内,再加入____________(选填一个序号)试剂,实验现象是:______________________________________。
Ⅱ.若SO2过量:取适量D中溶液滴加至盛有______________(选填一个序号)试剂的试管内,实验现象是:________________。
(3)另一小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质。
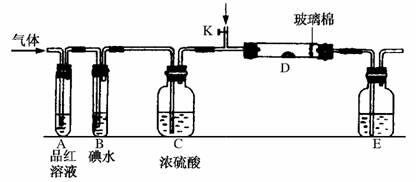
①若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同?________(填“相同”或“不相同”);若装置D装的是铁粉,通入Cl2与铁粉充分反应时现象为______________________________。
②若装置B中装有5.0 mL 1.0 mol/L的碘水,当通入足量Cl2完全反应后,共转移了5.0×10-2mol电子,该反应的化学方程式为________________________________________________________________________。
(4)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为4?3,当Cl2与含X的溶液完全反应后,有浅黄色沉淀产生,取上层清液加入氯化钡溶液,有白色沉淀产生。写出Cl2与含X的溶液反应的离子方程式________________________。
解析:(1)分析装置图可知,气体发生装置B产生的气体是Cl2,气体发生装置A产生的气体是SO2。(2)为确定Cl2过量,即应利用其强氧化性予以确认,故选具有还原性的FeCl2,Cl2将Fe2+氧化为Fe3+,KSCN和苯酚均能与Fe3+发生特征反应,使溶液变为红色或紫色。从所给试剂及SO2的性质来看,选择品红溶液,利用SO2的特征性质(漂白性)或选KMnO4溶液(或氯化铁溶液),利用SO2的还原性。(3)①两种气体都有漂白性,都能使品红溶液褪色;铁与氯气反应产生棕黄色的烟;②氯气的氧化性强于碘单质,将碘单质氧化,碘单质的物质的量为5.0×10-3mol,转移电子为5.0×10-2mol,说明碘元素从0价升高到+5价。(4)由“元素S和O组成-2价酸根离子X,X中S和O的质量比为4?3”可知,X为S2O,Cl2与S2O反应生成SO和S。
答案:(1)SO2
(2)Ⅰ.② ③(或④) 溶液呈血红色(或紫色)
Ⅱ.⑤ 红色褪成无色,加热后又变为红色
(或⑥ 溶液变成无色)(或① 溶液变成浅绿色)
(3)①相同 产生棕色的烟
②5Cl2+I2+6H2O===2HIO3+10HCl
(4)S2O+Cl2+H2O===SO+S↓+2Cl-+2H+
19.(9分)(2010·四川省检测)现有A、B、C、D、E五种中学教材中常见的金属单质,其单质和最高价氧化物对应的水化物的有关信息如下表所示:
|
单质 |
A |
B |
C |
D |
E |
|
最高价氧化 物对应水化 物的稳定性 |
难分解 |
能分解 |
能分解 |
能分解 |
能分解 |
|
单质 |
溶于水剧烈反应 |
缓慢溶于热水 |
溶于强碱性溶液 |
难溶于冷的浓硝酸 |
溶于浓稀硝酸 |
已知A、B、C的组成元素位于同一短周期,D和E的组成元素位于同一周期,D的低价氢氧化物在空气中会发生颜色变化,E在空气中生锈呈绿色。
根据要求,回答下列问题:
(1)C盐水溶液可能呈酸性,也可能呈碱性,用离子方程式解释,碱性:__________________;酸性:________________________。
(2)以B、C为电极,A的氢氧化物的水溶液为电解质溶液,构成原电池。写出B极的电极反应式:________________________。
(3)用离子方程式表示D的单质能与D的化合物在水溶液中发生化合反应:________________________________________________________________________。
(4)在加热条件下,C的单质能与E的氧化物发生置换反应,写出可能的化学方程式:____________________________。
解析:依题意,钠、镁、铝是位于第三周期的常见金属元素,其中铝能与强碱反应,钠与水剧烈反应,而镁与热水缓慢反应,故A为钠,B为镁,C为铝;氢氧化亚铁在空气中变成氢氧化铁,由白色变成灰绿色,最终变成红褐色,铁在冷的浓硝酸中发生钝化,铜绿呈绿色,所以,D为铁,E为铜。(1)铝盐有偏铝酸盐、铝盐两类,如偏铝酸钠是弱酸强碱盐,水解呈碱性,硫酸铝、氯化铝是强酸弱碱盐,水解呈酸性。(2)镁、铝与氢氧化钠溶液组成的原电池中,镁为正极,发生还原反应,水中H+得电子生成氢气。(3)铁有0价、+2价、+3价等,铁与三价铁盐(如硫酸铁,氯化铁等)在水溶液中发生归中反应。(4)铝与某些金属氧化物能发生铝热反应,铜的氧化物有氧化铜和氧化亚铜两种。
答案:(1)AlO+2H2O⇌Al(OH)3+OH-
Al3++3H2O⇌Al(OH)3+3H+
(2)2H++2e-===H2↑或2H2O+2e-===2OH-+H2↑
(3)2Fe3++Fe===3Fe2+
(4)2Al+3CuO3Cu+Al2O3,2Al+3Cu2O6Cu+Al2O3
20.(8分)(2010·重庆市调研)已知A是一种含有两种元素的有机溶剂,分子结构与C相似,F是一种黄色固体,H是一种白色粉末,N有磁性,B、F、L、O、P是中学化学常见单质,J的相对分子质量比D大16。反应①是侯氏制碱法的重要反应。以上各物质在一定条件下有如下反应关系:
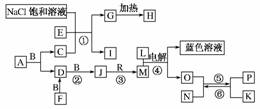
(1)组成单质P的元素在周期表中的位置为________,A的电子式为________________,G的俗名为________。
(2)N与M的稀溶液反应的离子方程式为__________________。
(3)反应①的化学方程式为______________________。
(4)反应④中阳极的电极反应式为________________________________________________________________________。
(5)当反应⑤在高温下生成1.5 mol P时有________mol的电子转移。
解析:反应①是侯氏制碱法原理,其反应为NaCl+CO2+NH3+H2O===NaHCO3↓+NH4Cl,再结合框图转化可知,A应该是产生CO2和SO2的反应,故A为CS2,根据CO2的电子式可写出CS2的电子式,CS2燃烧生成CO2(C)、SO2(D),SO2催化氧化生成SO3(J),SO3与H2O反应生成H2SO4(M)。用Cu作电极电解稀H2SO4溶液时,阳极上Cu失去电子而溶解得到蓝色CuSO4溶液,阳极电极反应为Cu-2e-===Cu2+,溶液中的H+在阴极得电子产生H2(O),又因为N有磁性,所以N为Fe3O4,Fe3O4被H2还原生成Fe(P)、H2O,Fe3O4中含有+2价和+3价铁,所以与稀H2SO4反应时生成Fe2+、Fe3+(Fe3O4+8H+===Fe2++2Fe3++4H2O)。根据反应:Fe3O4+4H23Fe+4H2O,生成1.5 mol Fe转移4 mol电子。
答案:(1)第四周期Ⅷ族 ???C??? 小苏打
(2)Fe3O4+8H+===Fe2++2Fe3++4H2O
(3)NaCl+NH3+CO2+H2O===NaHCO3↓+NH4Cl
(4)Cu-2e-===Cu2+
(5)4
21.(7分)(2009·厦门)已知A、B、C是中学化学的常见物质,它们在一定条件下有如下转化关系。
ABC
(1)若A是一种淡黄色固体,B是造成酸雨的“罪魁祸首”,则X的化学式为________。
(2)若A的体积分数为75%的溶液可用作医疗消毒剂;B与新制氢氧化铜共热,有砖红色沉淀生成;C能使湿润的蓝色石蕊试纸变红。则A与C在浓硫酸和加热条件下反应的化学方程式为____________________________________。
(3)若A、B、C的焰色反应均为黄色,A是一种工业原料,B俗称小苏打,电解C的水溶液可以得到两种气态产物,这两种气态产物在工业上可以合成X,则电解C的水溶液的离子方程式为________________________________。
(4)若A、C为无色溶液。B为白色胶状沉淀,是治疗胃酸过多的一种药物的主要成分,X的焰色反应为黄色,则C溶液中除氢氧根外还存在的阴离子的化学式为____________________。
(5)若A、B、C均为氧化物,X是一种黑色固态非金属单质,则B分子的结构式为______________________。
解析:(1)B是造成酸雨的“罪魁祸首”,可知B是SO2,结合A的颜色和题中转化关系,可知A为S,X为O2。(2)A为乙醇,结合转化关系和B、C的性质可知,B是乙醛、C是乙酸,故A、C在浓硫酸作用下的反应是乙醇与乙酸发生的酯化反应。(3)B是NaHCO3,A是Na2CO3,X为HCl,C为NaCl。(4)由信息知B为Al(OH)3,X为含有Na元素的化合物,结合转化关系,可推出A中含有Al3+(即A是可溶性铝盐),X为NaOH,可实现A→B→C的连续转化,则C为NaAlO2,所以C溶液中的阴离子除OH-外,还有AlO或[Al(OH)4]-。(5)因A、B、C都是氧化物,X是黑色固态非金属单质,利用转化关系,结合熟悉的物质可推知X是碳单质;则A为CuO或Fe2O3等氧化物,B为CO2,C为CO,故B的结构式为O===C===O。
答案:(1)O2
(2)CH3COOH+C2H5OH CH3COOC2H5+H2O
CH3COOC2H5+H2O
(3)2Cl-+2H2OH2↑+Cl2↑+2OH-
(4)AlO或[Al(OH)4]-
(5)O===C===O
22.(8分)(2010·云南摸底考试)将2.5 g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶于水,制成稀溶液,然后向该溶液中逐滴加入1 mol·L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如下图所示:

(1)写出OA段所发生反应的离子方程式__________________。
(2)当加入35 mL盐酸时,产生CO2的体积为________mL(标准状况)。
(3)原混合物中NaOH的质量为________g,碳酸钠的质量分数为________。
解析:A点时开始产生CO2气体,故OA阶段发生的反应为OH-与H+作用生成水,CO与H+作用生成HCO。加入35 mL盐酸时,有10 mL盐酸与HCO反应生成CO2,利用HCO+H+===CO2↑+H2O进行计算。
设混合物中Na2CO3、NaHCO3、NaOH物质的量分别为x、y、z。A点时溶液中溶质为NaCl、NaHCO3,B点时为NaCl。则有:x+z=0.025×1,2x+y+z=0.045×1,106x+84y+40z=2.5。解得z=0.015 mol,x=y=0.01 mol。则m(NaOH)=0.6 g,m(Na2CO3)=1.06 g,w(Na2CO3)=×100%=42.4%。
答案:(1)H++OH-===H2O;CO+H+===HCO
0.(2)224 (3)6 42.4%
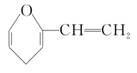 ,A的同分异构体中带苯环的化合物(烯醇结构除外)共有( )
,A的同分异构体中带苯环的化合物(烯醇结构除外)共有( )