3.下列选用的相关仪器符合实验要求的是( )
|
A |
B |
C |
D |
|
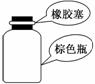
存放浓硝酸 |
分离水和乙酸乙酯 |
准确量取9.50 mL水 |
实验室制取乙烯 |
 |
 |
 |
 |
解析:浓硝酸具有强氧化性且易挥发,故不能用橡胶塞,一般用玻璃塞,A项错误;水和乙酸乙酯互不相溶且二者密度不同,可以用分液漏斗分离,B项正确;量筒量取液体只能精确到0.1 mL,C项错误;实验室制取乙烯需要控制温度在170℃,量程为100℃的温度计不能满足实验要求,D项错误.
答案:B
 酸反应制备CO2气体.下列装置可用于CO2气体的提纯和干燥.
酸反应制备CO2气体.下列装置可用于CO2气体的提纯和干燥.
 选用的仪器是________.
选用的仪器是________. 主要实验步骤设计如下:
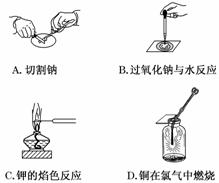
主要实验步骤设计如下: 甲、乙两位同学进行了以下操作和方案设计.
甲、乙两位同学进行了以下操作和方案设计.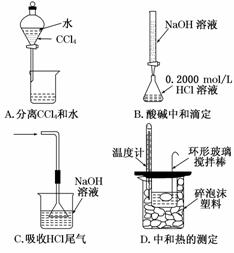
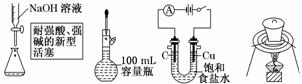
 H溶液应保存在带玻璃塞的试剂瓶中
H溶液应保存在带玻璃塞的试剂瓶中