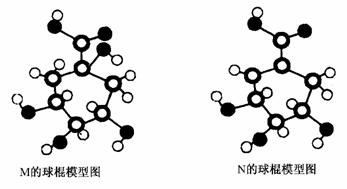
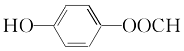
18.(9分)某种溶液仅含下表离子中的5种(不考虑水的电离与离子水解),且各种离子的物质的量均为1 mol。
|
阳离子 |
K+ Ba2+ Fe2+ Al3+ Fe3+ Mg2+ |
|
阴离子 |
OH- HCO CO Cl- NO SO |
若向原溶液中加入足量的盐酸,有无色气体生成。经分析反应后溶液中阴离子的种类没有变化。
(1)溶液中________(填“一定”、“一定不”或“可能”)含有HCO或CO,理由是___________________________________。
(2)原溶液中所含的阴离子为________,阳离子为________。
(3)向原溶液中加入足量的盐酸,有无色气体生成的离子反应方程式为_________________________________________。
(4)若向原溶液中加入足量的氢氧化钠溶液,充分反应后将沉淀过滤、洗涤、干燥灼烧至恒重,得到固体质量为________g。
解析:若向原溶液中加入足量的盐酸,有无色气体生成,且反应后溶液中阴离子种类没有变化,说明不可能含有碳酸根离子或碳酸氢根离子。可以推测无色气体由其他离子间反应生成,根据表中的离子种类可以推测只有Fe2+、NO在酸性条件下反应生成NO。加入盐酸阴离子种类没有改变,说明原溶液中含有Cl-,若只含有Cl-、NO两种阴离子,因为离子均为1 mol,利用电荷守恒分析,是不可能的,所以一定含有SO;再根据电荷守恒确定还有一种阳离子带两个单位电荷,可以确定只有Mg2+。灼烧后得到的固体是Fe2O3和MgO,根据守恒计算最终固体质量为120 g。
答案:(1)一定不 HCO与CO均可与盐酸反应生成二氧化碳,造成阴离子种类有所变化
(2)Cl-、NO、SO Fe2+、Mg2+
(3)3Fe2++NO+4H+===3Fe3++NO↑+2H2O
(4)120
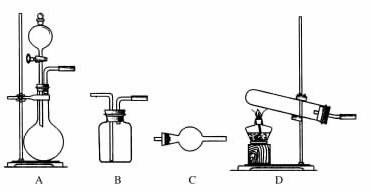
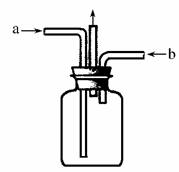
13.用下图所示实验装置进行实验(必要时可以进行加热)时,下列实验现象描述不正确的是( )
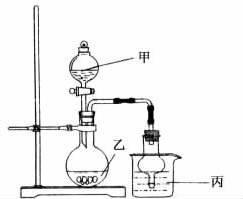
|
实验 |
试剂甲 |
试剂乙 |
试剂丙 |
丙中的现象 |
|
A |
H2O2 |
MnO2 |
FeCl2 |
溶液由浅绿色变为棕黄色 |
|
B |
浓氨水 |
CaO |
AgNO3 |
开始有白色沉淀生成,随后白色沉淀减少直至完全消失 |
|
C |
浓HNO3 |
Cu |
NaHCO3 |
有气泡生成 |
|
D |
H2SO4 |
Na2SO3 |
BaCl2 |
产生白色沉淀 |
解析:A选项,生成的氧气将FeCl2氧化为FeCl3;B选项,生成的氨气通入硝酸银溶液中,首先生成氢氧化银沉淀,然后氢氧化银溶解于氨水中;C选项浓硝酸与铜反应生成NO2,NO2溶于水生成硝酸,硝酸与NaHCO3反应生成二氧化碳;D选项,生成的二氧化硫不能与BaCl2溶液反应。
答案:D