摘要:14.A.B.C.D.E.F均为短周期元素.其原子序数逐渐增大.A.B.C三种元素原子核外电子层数之和为5.A.B两种元素的原子最外层电子数之和等于C元素原子最外层的电子数,B元素原子最外层的电子数是其电子层数的2倍.B与D的质子数之比为3∶4.A和C可以形成化合物CA3.E与D同主族.E与F同周期且原子半径是E>F. 回答下列问题: (1)B的最高价氧化物的电子式为 . (2)化合物C2A2分子中各原子的最外层均达到稳定结构.该分子的结构式为 . (3)能说明E.F的非金属性强弱关系的化学方程式为 . (4)化合物A4C2D3的溶液呈酸性的离子方程式为 . 解析:根据题给条件可推知.A为H元素.B为C元素.C为N元素.D为O元素.E为S元素.F为Cl元素. (1)C元素的最高价氧化物为CO2.根据O===C===O可写出其电子式. (2)N2H2中每个原子的最外层均达到稳定结构.即氮形成3对共用电子.H形成1对共用电子.故其结构式为H-N==N-H. (3)根据Cl2能氧化-2价的硫化物生成硫单质.即可证明Cl的非金属性比S强.如反应:Cl2+H2S===2HCl+S↓等. (4)NH4NO3溶液呈酸性是NH水解所致:NH+H2O NH3·H2O+H+. 答案:(1) ? (2)H-N===N-H (3)Cl2+H2S===2HCl+S↓ (4)NH+H2ONH3·H2O+H+
网址:http://m.1010jiajiao.com/timu3_id_84758[举报]
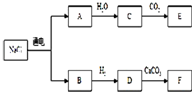 目前,世界各国主要采用电解熔融氯化钠的方法生产金属钠:2NaCl(熔融)
目前,世界各国主要采用电解熔融氯化钠的方法生产金属钠:2NaCl(熔融)
| ||
. |
(1)写出A、D、F的化学式.
B
Cl2
Cl2
;DHCl
HCl
;E Na2CO3
E Na2CO3
;(2)按要求写出下列反应的方程式:
A+H2O→C的化学方程式:
2Na+2H2O═2NaOH+H2↑
2Na+2H2O═2NaOH+H2↑
;D+CaCO3→F的离子方程式:
CaCO3+2H+═Ca 2++CO2↑+H2O
CaCO3+2H+═Ca 2++CO2↑+H2O
.已知A,B,C,D,E,F均为前四周期元素,A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍.C元素原子的M电子层的P亚层中有3个未成对电子.D元素原子核外的M层中只有两对成对电子,B离子与E离子具有相同的电子层结构.可形成E2B2,E2B型化合物.F元素位于元素周期表的ds区.其原子与E原子具有相同的最外层电子数.
请回答下面的问题:
(1)根据以上信息推断:①B元素为
(2)当n=2时.A与氢元素形成的相对分子质量为26的分子应属于
(3)DCl2分子中,中心原子D有
查看习题详情和答案>>
请回答下面的问题:
(1)根据以上信息推断:①B元素为
O
O
(2)当n=2时.A与氢元素形成的相对分子质量为26的分子应属于
非金属
非金属
分子(填记性或非极性),该分子中有3
3
个σ键和2
2
个π键(3)DCl2分子中,中心原子D有
2
2
对孤对电子,用价层电子对互斥模型推测:DCl2分子的空间构型为V
V
型.现有六种元素A、B、C、D、E、F均为周期表中前20号元素,且原子序数依次增大.已知A和B是形成化合物种类最多的两种元素;B元素和C元素通常形成电子数为14或22的化合物.D元素的原子半径是短周期主族元素中最大的;E元素在地壳中含量居第二位;F是组成人体骨骼的牙齿的主要元素.
请回答以下问题:
(1)请画出F的离子结构示意图: ;由C、A两种元素形成的18电子化合物的电子式为 ;
(2)工业上制取E单质的化学方程式为: ;
(3)由以上六种元素两两组合所形成的化合物中,既含有离子键又含有非极性共价键的常见化合物有 和 (填化学式);它们都能与水反应生成气体,写出其中一个属于非氧化化还原反应的化学方程式 ;
(4)由A、B两种元素形成的正四面体分子是一种常见的气体燃料.通常状况下1g该物质完全燃烧生成液态水时所释放的能量为51.25kg/mol,请写出表示其燃烧热的热化学方程式: ;
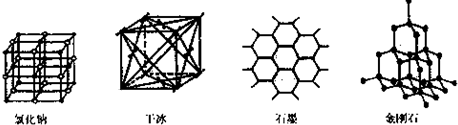
(5)如图是中学常见的几种晶体结构.有关说法正确的是 (填选项).
A.氯化钠的晶体结构中,和钠离子最近且等距离的氯离子组成了一个正八面体
B.干冰晶体是CO2分子通过范德华力结合形成的
C.石墨晶体中碳原子数与所形成的共从键数目之比为2:3
D.金刚石晶体是由五个碳原子形成的正四面体分子构成的.
查看习题详情和答案>>

请回答以下问题:
(1)请画出F的离子结构示意图:
(2)工业上制取E单质的化学方程式为:
(3)由以上六种元素两两组合所形成的化合物中,既含有离子键又含有非极性共价键的常见化合物有
(4)由A、B两种元素形成的正四面体分子是一种常见的气体燃料.通常状况下1g该物质完全燃烧生成液态水时所释放的能量为51.25kg/mol,请写出表示其燃烧热的热化学方程式:
(5)如图是中学常见的几种晶体结构.有关说法正确的是
A.氯化钠的晶体结构中,和钠离子最近且等距离的氯离子组成了一个正八面体
B.干冰晶体是CO2分子通过范德华力结合形成的
C.石墨晶体中碳原子数与所形成的共从键数目之比为2:3
D.金刚石晶体是由五个碳原子形成的正四面体分子构成的.
A、B、C、D、E、F均为短周期元素,其原子序数依次增大.已知:A的最外层电子数等于其电子层数;B的最外层电子数是次外层电子数的两倍;D是地壳中含量最高的元素;D和F、A和E分别同主族;E是所有短周期主族元素中原子半径最大的元素.根据以上信息回答下列问题:
(1)B与D形成化合物BD2的结构式为 ,B元素形成的同素异形体的晶体类型可能是 .
(2)A、C、D三元素能形成一种强酸甲,写出单质B与甲的浓溶液反应的化学反应方程式 . FB2气体通入BaCl2和甲的混合溶液,生成白色沉淀和无色气体CD,有关反应的离子方程式为 .
(3)均由A、D、E、F四种元素组成的两种盐,其相对分子质量相差16,写出它们在溶液中相互作用的离子方程式为 ;由B、D、E组成的盐溶于水后溶液显碱性,其原因是(用离子方程式表示) .
(4)C2A4─空气燃料电池是一种碱性燃料电池.电解质溶液是20%~30%的KOH溶液.则燃料电池放电时:正极的电极反应式是 ;负极的电极反应式为 .
查看习题详情和答案>>
(1)B与D形成化合物BD2的结构式为
(2)A、C、D三元素能形成一种强酸甲,写出单质B与甲的浓溶液反应的化学反应方程式
(3)均由A、D、E、F四种元素组成的两种盐,其相对分子质量相差16,写出它们在溶液中相互作用的离子方程式为
(4)C2A4─空气燃料电池是一种碱性燃料电池.电解质溶液是20%~30%的KOH溶液.则燃料电池放电时:正极的电极反应式是
A、B、C、D、E、F均为短周期元素;A、C具有相同的电子层数;E元素在B的下一周期;A与D同主族;原子半径大小为F>E>A>B>C.AC2常温下呈气态,通入紫色的石蕊溶液中会变红色,单质E可以在AC2中燃烧,发生置换反应.
回答:
(1)AC2的分子构型为 ,E在AC2中燃烧的化学方程式为 .
(2)A、D的最高价氧化物熔点更高是 (填物质化学式),其理由是 .
(3)B、C、E、F均能形成简单离子,其半径由大到小的顺序为 .(用离子符号表示)
(4)F3B是一种离子化合物,能与水反应生成两种碱性物质.将F3B加入到足量的盐酸中,写出发生反应的离子方程式 .
(5)A、E两元素形成阴、阳离子质量比为1:1的离子化合物能与水反应生成一种气体,此气体的结构式为 .
查看习题详情和答案>>
回答:
(1)AC2的分子构型为
(2)A、D的最高价氧化物熔点更高是
(3)B、C、E、F均能形成简单离子,其半径由大到小的顺序为
(4)F3B是一种离子化合物,能与水反应生成两种碱性物质.将F3B加入到足量的盐酸中,写出发生反应的离子方程式
(5)A、E两元素形成阴、阳离子质量比为1:1的离子化合物能与水反应生成一种气体,此气体的结构式为