14.(14分)某兴趣活动小组利用物质间的相互转化,设计成一个平面魔方,如下图所示.
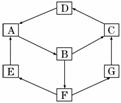
已知①A、B、C、D、G含有同种元素.
②
|
|
A(单质) |
B溶液 |
D固体 |
G溶液 |
|
颜色 |
银白色 |
黄色 |
红棕色 |
浅绿色 |
③E是通常情况下密度最小的气体;B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀,也能将一种氧化物氧化为F,F是含有三种元素的化合物,与A反应生成E、G.
依据以上信息填空:
(1)写出D的化学式____________.
(2)G生成C的过程中所出现的现象为__________________________________________
________________________________________________________________________________________________________________________________________________.
(3)写出下列反应的化学方程式:
E―→A___________________________________________________________________;
A―→B___________________________________________________________________.
(4)B―→F的离子方程式为___________________________________________________.
解析:这个平面魔方的突破口在于溶液的颜色及E的密度.E为H2;B中既含Fe3+又含Cl-,故B为FeCl3;从颜色分析此魔方是有关铁的单质及其化合物的转化关系图,则A为Fe,再联想反应A(Fe)+F===H2↑+Fe2+,可知F为酸且为硫酸,则G为硫酸亚铁,D为Fe2O3,C为Fe(OH)3,然后根据题意回答问题.
答案:(1)Fe2O3
(2)先产生白色沉淀,迅速变为灰绿色,最后变为红褐色
(3)4H2+Fe3O4高温3Fe+4H2O
2Fe+3Cl2点燃2FeCl3
(4)2Fe3++SO2+2H2O===2Fe2++SO+4H+

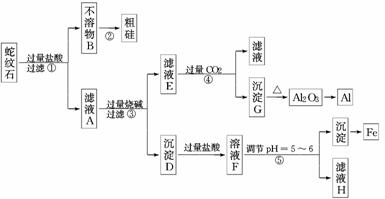
13.(14分)蛇纹石矿可以看作由MgO、Fe2O3、Al2O3和SiO2组成.某实验小组设计如下流程欲分别制得单质Mg、Fe、Al和Si.
有关氢氧化物沉淀时的pH见下表:
|
金属阳离子 |
氢氧化物开始沉淀时的pH |
氢氧化物完全沉淀时的pH |
|
Fe3+ |
1.9 |
3.2 |
|
Mg2+ |
9.4 |
11.6 |
请回答下列问题:
(1)滤液A中含有的阳离子有________________________________________________.
(2)操作②中涉及的化学方程式为_____________________________________________,
操作④中生成沉淀G的离子方程式为_________________________________________.
(3)操作⑤中调节pH为5-6时,可以用到的试剂为(填序号)________.
a.NaOH溶液 b.氨水
c.MgO d.Mg(OH)2
(4)由滤液H制取金属Mg的流程如下 :
加热浓缩冷却结晶脱水―→
该流程中由MgCl2冶炼Mg的方法是________.
在干燥的HCl气流中加热MgCl2·6H2O制取无水氯化镁的原因是__________________.
解析:(1)滤液A中的阳离子有H+、Al3+、Fe3+、Mg2+.
(2)B为二氧化硅,用碳还原二氧化硅,产物为CO和Si;偏铝酸钠溶液中通入过量的二氧化碳生成氢氧化铝和碳酸氢钠.
(4)在干燥的氯化氢气流中加热氯化镁晶体,可抑制氯化镁的水解,电解氯化镁制取镁.
答案:(1)Fe3+、Al3+、Mg2+、H+
(2)SiO2+2C高温Si+2CO↑
AlO+CO2+2H2O===Al(OH)3↓+HCO
(3)cd
(4)电解 防止Mg2+水解
12.(8分)某教科书对“铝热反应”实验的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”,“纸漏斗的下部被烧穿,有熔融物落入沙中”.已知:Al、Fe的熔点、沸点数据如下:
|
物质 |
Al |
Fe |
|
熔点(℃) |
660 |
1
535 |
|
沸点(℃) |
2
467 |
2
750 |
(1)某同学猜测,铝热反应所得到的熔融物是铁铝合金.理由是:该反应放热能使铁熔化,而铝的熔点比铁低,所以铁和铝能形成合金.你认为他的解释是否合理?________(填“合理”或“不合理”).
(2)请你根据已有知识找出一种验证产物中有Fe的最简单的方法:______________________________________________________________.
(3)设计一个简单的实验方案,证明上述所得的熔融物中含有金属铝.请填写下列表格:
|
实验操作、现象及结论 |
|
|
有关反应的化学方程式 |
|
解析:(1)因为铝热反应放出大量的热使生成的铁呈熔融状态,由题表知铝的熔、沸点比铁的低,故放出的热使铝熔化,故可以猜测熔融物是铁铝合金.
(2)最简单的方法就是利用磁铁吸引产物,若有铁,则会被磁铁吸引.
(3)利用铝能与氢氧化钠溶液反应产生氢气来鉴别,铁不能与氢氧化钠溶液反应.
答案:(1)合理
(2)用磁铁吸引,若能吸附,说明有铁生成
(3)取少量样品放入试管,加入NaOH溶液,若有气泡产生,说明该熔融物中有铝
2Al+2NaOH+2H2O===2NaAlO2+3H2↑
7.将Zn粉加入FeCl3和CuCl2的混合溶液中,充分反应后容器底部有金属固体存在,下表中列出的阳离子和金属对应关系正确的是( )
|
选项 |
A |
B |
C |
D |
|
溶液中阳离子 |
Cu2+、Fe3+、Zn2+ |
Cu2+、Fe3+ |
Cu2+、Fe2+、Zn2+ |
Cu2+、Fe2+ |
|
底部金属 |
Cu |
Fe、Zn |
Cu |
Cu、Fe |
解析:选项A中Fe3+能与Cu发生反应,A错误;选项B中Fe3+能与Fe、Zn发生反应,B错误;选项D中Fe能与Cu2+反应,D错误.
答案:C