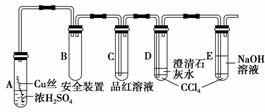
13.(2010·模拟题)实验室用粗锌和稀硫酸反应制氢的废液中含有大量的硫酸锌。因粗锌
中常含有铁等杂质,溶液中混有一定量的硫酸亚铁。为充分利用制氢废液,某校化
学兴趣小组以制氢气的废液为原料来制取皓矾(ZnSO4·7H2O)并探究其性质。
(1)制备皓矾的实验流程如图所示:

已知:开始生成氢氧化物沉淀到沉淀完全的pH范围分别为:
Fe(OH)3:2.7-3.7 Fe(OH)2:7.6-9.6 Zn(OH)2:5.7-8.0
试回答下列问题:
①实验室常用粗锌和稀硫酸反应而不用纯锌和稀硫酸反应制氢气,除了纯锌成本较
高外,还有一重要原因是
_______________________________________________________________________;
②试剂E供选择使用的有:Zn粉、ZnO、Zn(OH)2、ZnCO3、ZnSO4等,应选用
________,其理由是
_____________________________________________________________________;
晶体2,该过程的名称是________;
→晶体2,该过程的名称是________;
④在得到皓矾时,向晶体中加入少量酒精洗涤而不用水的原因是
______________________________________________________________________。
(2)探究ZnSO4·7H2O的性质
⑤称取28.7 g ZnSO4·7H2O研细后置于坩埚中小心加热,测得残留固体的质量与温度
的对应数据见下表:
|
温度(℃) |
60 |
240 |
930 |
1
000 |
|
残留固体质量(g) |
19.7 |
16.1 |
8.1 |
8.1 |
试写出ZnSO4·7H2O加热到1000℃时的反应方程式:
_______________________________________________________________________。
解析:本题是一道结合化工的推断型实验题,难度一般。
(1)①形成原电池可加快锌与硫酸的反应速率。
②注意在满足沉淀的同时,不能引进新的杂质。
(2)⑤通过题给表格数据分析可知930℃分解完全,再通过计算得出反应方程式。
答案:(1)①粗锌中含有的杂质可与锌形成原电池,可加快锌与硫酸的反应速率
②ZnO[ZnCO3或Zn(OH)2] 调节溶液的pH至3.7-5.7,使得Fe3+完全转化为Fe(OH)3
沉淀,同时避免引入新的杂质 ③重结晶 ④为了冲洗掉晶体表面的水及杂质离
子,防止晶体溶解,影响产率
(2)⑤ZnSO4·7H2OZnO+SO3↑+7H2O↑
12.(2010·河北师大附中月考题)小明同学在学习“硫酸及其盐的某些性质与用途”的过
程中,进行如下实验探究。
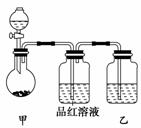
实验一:探究浓硫酸的氧化性
将实验室常用的药品放入如图所示的实验装置后,加热装置甲。(夹持和加热装置省
略)
(1)该装置设计上存在明显缺陷,请指出:
_______________________________________________________________________。
(2)写出装置甲中反应的化学方程式:
_______________________________________________________________________。
装置乙中的试剂是
_______________________________________________________________________。
实验二:探究某硫酸亚铁盐固体是否变质
(3)请你帮助小明同学完成如下实验方案:
|
实验操作 |
预期现象和结论 |
|
|
|
解析:(1)制气装置不能在封闭体系中进行,否则易引起爆炸,因此尾气吸收装置乙
中的广口瓶不能加瓶塞。(2)根据品红溶液可推测发生装置中生成了SO2气体,因此
可选用Cu与浓硫酸反应或C与浓硫酸反应。(3)检验硫酸亚铁盐固体是否变质即检验
样品中有无Fe3+,检验Fe3+最灵敏的试剂是KSCN溶液。
误区警示:在解答第(3)题时应注意,题中只要求检验样品是否变质,因此没有必要
检验样品中有无Fe2+。
 答案:(1)装置乙中的广口瓶不应加瓶塞
答案:(1)装置乙中的广口瓶不应加瓶塞

 (2)Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O(或C+2H2SO4(浓) CO2↑+
(2)Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O(或C+2H2SO4(浓) CO2↑+
2SO2↑+2H2O,其他合理答案也可) NaOH溶液
(3)
|
实验操作 |
预期现象和结论 |
|
往一支试管中加入少量固体样品,加水溶解,再滴加几滴KSCN溶液 |
若溶液变为血红色,说明该固体已变质;若溶液未变为血红色,说明该固体没有变质 |
11.请根据工业制硫酸的有关知识回答下列问题:
(1)黄铁矿在沸腾炉中反应的化学方程式为
_______________________________________________________________________。
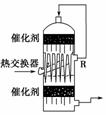
(2)在硫酸工业生产中,为了提高SO2的转化率,且能充分利用热能,采用了中间有
热交换器的接触室(如图所示)。按此密闭体系中气体的流向判断,在R处流出的气体
中除N2外的主要组成为( )
A.SO2 B.SO2、SO3
C.SO2、O2 D.SO3、O2、SO2
(3)接触法制硫酸过程中:2SO2(g)+O2(g) 2SO3(g)。根据下表中的数据判
2SO3(g)。根据下表中的数据判
断下列图象正确的是(填序号)________。
  压 强
压 强SO2 的转化率/% 温 度 |
p1 |
p2 |
|
400℃ |
99.6 |
99.7 |
|
500℃ |
96.9 |
97.8 |

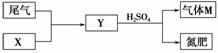
(4)下图表示的是工业制硫酸中尾气的综合利用,气体M回收后可进入接触室循环利
用,请根据图示判断X是(填名称)________,写出Y与硫酸反应生成M的化学方程
式:_____________________________________________________________。
解析:(1)黄铁矿与氧气在沸腾炉里反应;(2)该装置为接触室,R处流出的气体就是
在接触室中发生反应的反应物,其主要成分是二氧化硫和氧气;(3)根据反应特点和
数据表知,p2>p1,正反应是放热反应,降低温度,二氧化硫的转化率提高;增大压
强,三氧化硫的百分含量提高,AB图象符合题意。
答案:(1)4FeS2+11O22Fe2O3+8SO2 (2)C
(3)AB (4)氨水 (NH4)2SO3+H2SO4===(NH4)2SO4+H2O+SO2↑