14.A、B、C、D、E均为可溶于水的固体,组成它们的离子有
|
阳离子 |
Na+ Mg2+ Al3+ Ba2+ |
|
阴离子 |
OH- Cl- CO SO SO HSO HSO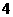 |
分别取它们的水溶液进行实验,结果如下:
①A溶液与B溶液反应生成白色沉淀,沉淀可溶于E溶液;
②A溶液与C溶液反应生成白色沉淀,沉淀可溶于E溶液;
③A溶液与D溶液反应生成白色沉淀,沉淀可溶于盐酸;
④B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减少,但不消失。
据此推断它们是
Ⅰ.A____________;B____________;C____________;D____________;E____________。
Ⅱ.请完成下列实验步骤的离子方程式:
(1)步骤①中生成白色沉淀的离子方程式 。
(2)步骤②中白色沉淀溶解的离子方程式 。
(3)步骤④中白色沉淀减少的离子方程式
Ⅲ.为确定E中的阳离子还应进行的实验操作是
。
解析:Ⅰ.本题为常见物质推断题的题型。取材为常见离子组成的物质。基本解法为寻觅“突破口”法。本题从物质A突破,A均能与B、C、D反应生成白色沉淀,可推知A中含有CO ,CO
,CO 只能与Na+组成可溶于水的固体,故A为Na2CO3。白色沉淀分别为Mg(OH)2、Al(OH)3、BaCO3。能够溶解两种白色沉淀的只有可能含有HSO
只能与Na+组成可溶于水的固体,故A为Na2CO3。白色沉淀分别为Mg(OH)2、Al(OH)3、BaCO3。能够溶解两种白色沉淀的只有可能含有HSO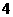 即E为NaHSO4或Mg(HSO4)2。B、C中含有Mg2+、Al3+,D中含有Ba2+,由④可推出B为Al2(SO4)3,D为Ba(OH)2,C为MgCl2。
即E为NaHSO4或Mg(HSO4)2。B、C中含有Mg2+、Al3+,D中含有Ba2+,由④可推出B为Al2(SO4)3,D为Ba(OH)2,C为MgCl2。
Ⅱ.在第一个问题分析的基础上,可知①中的白色沉淀为Al(OH)3,是Al3+与CO 发生双水解的产物;②中的白色沉淀为MgCO3,可与HSO
发生双水解的产物;②中的白色沉淀为MgCO3,可与HSO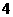 电离出的H+反应;④中的白色沉淀为BaSO4和Al(OH)3,Al(OH)3可继续与OH-反而溶解。
电离出的H+反应;④中的白色沉淀为BaSO4和Al(OH)3,Al(OH)3可继续与OH-反而溶解。
Ⅲ.为确定阳离子的存在,应进行焰色反应实验。
答案:Ⅰ.Na2CO3 Al2(SO4)3 MgCl2 Ba(OH)2 NaHSO4[或Mg(HSO4)2]
Ⅱ.(1)2Al3++3CO +3H2O===2Al(OH)3↓+3CO2↑
+3H2O===2Al(OH)3↓+3CO2↑
(2)MgCO3+2H+===Mg2++CO2↑+H2O
(3)Al(OH)3+OH-===AlO +2H2O
+2H2O
Ⅲ.用铂丝蘸取E的溶液,在酒精灯的火焰上灼烧,若火焰呈黄色则为Na+,否则为Mg2+
 +H+);一类是还原性物质:Fe、Fe(NO3)2、KI。然后根据题目要求选择反应物。
+H+);一类是还原性物质:Fe、Fe(NO3)2、KI。然后根据题目要求选择反应物。 ,Cl-未变化,溶液中自由移动的电荷的浓度基本不变,因而导电能力不会发生变化;向氨水中均匀通入HCl时,发生的反应为HCl+NH3·H2O===NH4Cl+H2O,因为NH3·H2O为弱电解质,原溶液中自由移动的离子浓度很小,当反应发生后,生成NH4Cl为强电解质,使自由移动离子浓度增大了,导电能力增强了。
,Cl-未变化,溶液中自由移动的电荷的浓度基本不变,因而导电能力不会发生变化;向氨水中均匀通入HCl时,发生的反应为HCl+NH3·H2O===NH4Cl+H2O,因为NH3·H2O为弱电解质,原溶液中自由移动的离子浓度很小,当反应发生后,生成NH4Cl为强电解质,使自由移动离子浓度增大了,导电能力增强了。 ===BaSO4↓+H2O H++OH-===H2O
===BaSO4↓+H2O H++OH-===H2O
 (3)丙组试剂的选择依据OH-+NH
(3)丙组试剂的选择依据OH-+NH 具有氧化性可将S2-、SO
具有氧化性可将S2-、SO