5.室温下,下列叙述正确的是(溶液体积变化忽略不计) ( )
|
|
① |
② |
③ |
④ |
|
溶液 |
氨水 |
氢氧化钠溶液 |
醋酸 |
盐酸 |
|
pH |
11 |
11 |
3 |
3 |
A.分别将等体积的③和④加水稀释100倍,所得溶液的pH:③<④
B.在①、②中分别加入氯化铵固体,两溶液的pH均增大
C.①、④两溶液等体积混合,所得溶液中c(C1-)> c (NH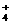 )> c (OH一)> c (H+)
)> c (OH一)> c (H+)
D.②、③两溶液混合,若所得溶液的pH=7,则c (CH3COO一)> c (Na+)
2.下列实验报告记录的实验现象正确的是( )
|
实 验 |
 |
|
|
|
|
记 |
|
|
|
|
|
录 |
|
|
|
|
|
A |
无色 |
无色 |
无现象 |
无色溶液 |
|
B |
红色 |
无色 |
白色沉淀 |
白色沉淀 |
|
C |
红色 |
无色 |
无色溶液 |
白色沉淀 |
|
D |
无色 |
无色 |
无色溶液 |
无色溶液 |
易错分析:对SO2的漂白性原理未理解透彻或对SO2与Ba2+(Ca2+)反应必须在碱性环境下才能进行不
清晰导致错选A项或C项。
解析:SO2通入a中溶液显红色,SO2不能使其褪色;SO2通入b中溶液褪为无色;SO2通入c中使溶
液显酸性,相当于有了稀硝酸,必然有SO42-生成,所以c中肯定有白色沉淀生成;SO2通入d中发
生了反应SO2+2OH-+Ba2+=BaSO3↓+H2O,所以有白色沉淀生成。
答案:B
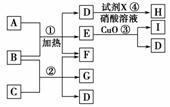
5.(2010·模拟题)Y是由硫的含氧酸盐组成的纯净物或者混合物,该物质可溶于水,食品
工业常将它用作漂白剂、防腐剂、疏松剂、护色剂及保鲜剂等。化学兴趣小组在实验
室对Y中硫元素的价态进行探究:①将过量的稀硝酸加入少许样品中,振荡;②取
少许反应后的溶液,滴加硝酸钡溶液,出现白色沉淀。甲认为不能由此确定Y中硫
的价态为+6价。
(1)上述实验中产生的沉淀是________。
(2)你认为甲的判断是否正确?答:________(填“正确”或“不正确”)。作出这种判
断的依据是
________________________________________________________________________。
(3)乙对Y中硫的价态作出三种猜想:①硫的价态是+6价;②硫的价态是+4价;
③硫的价态是+4价和+6价。请设计实验检验乙的猜想③是否正确,并按要求填写
下表。
限定实验仪器与试剂:烧杯、试管、玻璃棒、药匙、胶头滴管和试管架;1 mol·L-1
H2SO4、2 mol·L-1 HCl溶液、2 mol·L-1 HNO3、3% H2O2、0.5 mol·L-1 BaCl2溶液、
品红试纸、蒸馏水。
|
实验操作 |
预期现象及实验结论 |
|
|
|
解析:(1)、(2)略。(3)检验Y是否是亚硫酸盐与硫酸盐的混合物,必须先利用酸与
亚硫酸盐反应,检验生成的二氧化硫,然后检验硫酸盐。
答案:(1)硫酸钡(或BaSO4)
(2)正确 硝酸有强氧化性,无论样品中的硫是+4价还是+6价,加入稀硝酸和硝
酸钡后最终都有硫酸钡沉淀生成
(3)
|
实验操作 |
预期现象及实验结论 |
|
①取少许样品于试管中,加入足量的2 mol·L-1 HCl溶液,并将湿润的品红试纸置于试管口 ②往上述反应后溶液中再滴加0.5 mol·L-1 BaCl2溶液 |
品红试纸褪色(或不褪色),样品中含有(不含)+4价硫元素 有(无)白色沉淀生成,样品中含有(不含)+6价硫元素 |
|
易错点 |
一 |
 |
不能够熟练应用“---”氧化还原反应线或未足够重视O3、H2O2的 |
性质、SO2的特性、SO42-的检验等内容
 述正确的是 ( )
述正确的是 ( )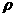 :1.19 g·
:1.19 g· )的浓盐酸配制100 mL 1 mol·
)的浓盐酸配制100 mL 1 mol·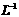 的盐酸溶液,用到的量器为100 mL的量筒和100 mL的容量瓶
的盐酸溶液,用到的量器为100 mL的量筒和100 mL的容量瓶