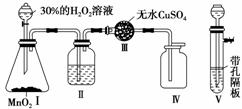
3.(2010·湖北黄冈中学月考)下列反应中,氧化剂与还原剂的物质的量之比为1∶2的是( )
①O3+2KI+H2O===2KOH+I2+O2 ②SiO2+2CSi+2CO↑ ③SiO2+3CSiC+2CO↑ ④4HCl(浓)+MnO2MnCl2+Cl2↑+2H2O
A.仅有② B.仅有②④ C.仅有②③④ D.①②③④
解析:
|
|
① |
② |
③ |
④ |
|
氧化剂 |
O3 |
SiO2 |
C |
MnO2 |
|
还原剂 |
KI |
C |
C |
HCl |
|
物质的量之比 |
1∶2 |
1∶2 |
1∶2 |
1∶2 |
答案:D