网址:http://m.1010jiajiao.com/timu3_id_81299[举报]
(1)制备皓矾的实验流程如图所示.
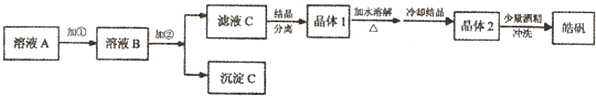
已知:开始生成氢氧化物沉淀到沉淀完全的pH范围分别为:
Fe(OH)3:2.7一3.7
Fe(OH)2:7.6一9.6
Zn(OH)2:5.7一8.0
试回答下列问题:①加入的试剂①,供选择使用的有:氨水、NaClO溶液、20%的H2O2、浓硫酸、浓硝酸等,应选用
②加入的试剂②,供选择使用的有:Zn粉、ZnO、Zn(OH)2、ZnCO3、ZnSO4等,应选用
③从晶体1→晶体2,该过程的名称是
④在得到皓矾时,向晶体中加入少量酒精洗涤而不用水的原因是
(2)探究ZnSO4?7H2O的性质
⑤称取28.7g ZnSO4?7H2O研细后置于坩埚中小心加热,测得残留固体的质量与温度的对应数据见下表:
| 温度(℃) | 60 | 240 | 930 | 1000 |
| 残留固体质量(g) | 19.7 | 16.1 | 8.1 | 8.1 |
| ||
| ||
⑥取少量ZnSO4?7H2O配成溶液向其中逐滴加入NaOH溶液,发现先产生白色沉淀后又逐渐溶解;若改用氨水得到相同的现象.查资料知,氢氧化锌与氢氧化铝均有两性,且锌离子可与氨水形成络合离子[Zn(NH3)4]2+.则Zn(OH)2沉淀中加入NaOH溶液和加氨水均得到无色溶液的离子反应方程式为:

已知:开始生成氢氧化物沉淀到沉淀完全的pH范围分别为:Fe(OH)3:2.7-3.7Fe(OH)2:7.6-9.6 Zn(OH)2:5.7-8.0试回答下列问题:?
(1)加入的试剂①,供选择使用的有:氨水、NaClO溶液、20%的H2O2、浓硫酸、浓硝酸等,最好选用
(2)加入的试剂②,供选择使用的有:a、Zn粉,b、ZnO,c、Zn(OH)2,d、ZnCO3,e、ZnSO4等,可选用
(3)从晶体1→晶体2,该过程的名称是
(4)在得到皓矾时,向晶体中加入少量酒精洗涤而不用水的原因是
(9分)化学实验室通常用粗锌和稀硫酸反应制氢气,因此在制氢废液中含有大量的硫酸锌。同时,由于粗锌中还含有铁等杂质,使得溶液中混有一定量的硫酸亚铁,为了充分利用制氢废液,常用其制备皓矾(ZnSO4·7H2O)。某校化学兴趣小组的同学以制氢气的废液为原料来制取皓矾。制备皓矾的实验流程如下图所示。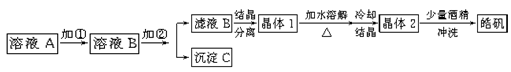
已知:开始生成氢氧化物沉淀到沉淀完全的pH范围分别为:Fe(OH)3:2.7-3.7 Fe(OH)2:7.6-9.6 Zn(OH)2:5.7-8.0试回答下列问题:?
(1)加入的试剂①,供选择使用的有:氨水、NaClO溶液、20%的H2O2、浓硫酸、浓硝酸等,最好选用 ,其理由是 ;
(2)加入的试剂②,供选择使用的有:a、Zn粉,b、ZnO,c、Zn(OH)2,d、ZnCO3,e、ZnSO4等,可选用 ;
(3)从晶体1→晶体2,该过程的名称是 ;
(4)在得到皓矾时,向晶体中加入少量酒精洗涤而不用水的原因是 。
(10分)化学实验室通常用粗锌和稀硫酸反应制氢气,因此在制氢废液中含有大量的硫酸锌。同时,由于粗锌中还含有铁等杂质,使得溶液中混有一定量的硫酸亚铁,为了充分利用制氢废液,常用其制备皓矾(ZnSO4·7H2O)。某校化学兴趣小组的同学以制氢气的废液为原料来制取皓矾。制备皓矾的实验流程如下图所示。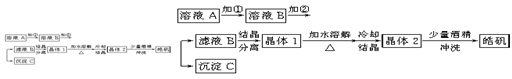
已知:开始生成氢氧化物沉淀到沉淀完全的pH范围分别为:Fe(OH)3:2.7-3.7
Fe(OH)2:7.6-9.6 Zn(OH)2:5.7-8.0试回答下列问题:?
(1)加入的试剂①,供选择使用的有:氨水、NaClO溶液、20%的H2O2、浓硫酸、浓硝酸等,最好选用 ,其理由是 ;
(2)加入的试剂②,供选择使用的有:a、Zn粉,b、ZnO,c、Zn(OH)2,d、ZnCO3,e、ZnSO4等,可选用 ;
(3)从晶体1→晶体2,该过程的名称是 ;
(4)在得到皓矾时,向晶体中加入少量酒精洗涤而不用水的原因是 。
(10分)化学实验室通常用粗锌和稀硫酸反应制氢气,因此在制氢废液中含有大量的硫酸锌。同时,由于粗锌中还含有铁等杂质,使得溶液中混有一定量的硫酸亚铁,为了充分利用制氢废液,常用其制备皓矾(ZnSO4·7H2O)。某校化学兴趣小组的同学以制氢气的废液为原料来制取皓矾。制备皓矾的实验流程如下图所示。
已知:开始生成氢氧化物沉淀到沉淀完全的pH范围分别为:Fe(OH)3:2.7-3.7
Fe(OH)2:7.6-9.6 Zn(OH)2:5.7-8.0试回答下列问题:?
(1)加入的试剂①,供选择使用的有:氨水、NaClO溶液、20%的H2O2、浓硫酸、浓硝酸等,最好选用 ,其理由是 ;
(2)加入的试剂②,供选择使用的有:a、Zn粉,b、ZnO,c、Zn(OH)2,d、ZnCO3,e、ZnSO4等,可选用 ;
(3)从晶体1→晶体2,该过程的名称是 ;
(4)在得到皓矾时,向晶体中加入少量酒精洗涤而不用水的原因是 。
查看习题详情和答案>>