28.(09海南卷 19)(20分)
19)(20分)
 19-1-19-3为选择题,每小题3分,在每小题给出的四个选项中,只有一项是符合题目要求的。19-4题为非选择题,请在答题纸相应位置做答。
19-1-19-3为选择题,每小题3分,在每小题给出的四个选项中,只有一项是符合题目要求的。19-4题为非选择题,请在答题纸相应位置做答。
 19-1.在以离子键为主的化学键中常含有共价键的成分。下列各对原子形成化学键中共价键成分最少的是:
19-1.在以离子键为主的化学键中常含有共价键的成分。下列各对原子形成化学键中共价键成分最少的是:
 A.Li,F B.Na,F C.Na,C1 D.Mg,O
A.Li,F B.Na,F C.Na,C1 D.Mg,O
 19-2.下列有关物质性质、结构的表述均正确,且存在因果关系的是:
19-2.下列有关物质性质、结构的表述均正确,且存在因果关系的是:
|
|
表述Ⅰ |
表述Ⅱ |
|
A |
在水中,NaCl的溶解度比I2的溶解度大 |
NaCl晶体中C1-与Na+间的作用力大于碘晶体中分子间的作用力 |
|
B |
通常条件下,CH4分子比PbH4分子稳定性高 |
Pb的原子半径比C的大,Pb与H之间的键能比C与H间的小 |
|
C |
在形成化合物时,同一主族元素的化合价相同 |
同一主族元素原子的最外层电子数相同 |
|
D |
P4O10、C6H12O6溶于水后均不导电 |
P4O10、C6H12O6均属于共价化合物 |
 19-3.下列说法中错误的是:
19-3.下列说法中错误的是:
 A.SO2、SO3都是极性分子
A.SO2、SO3都是极性分子
 B.在NH4+ 和[Cu(NH3)4]2+中都存在配位键
B.在NH4+ 和[Cu(NH3)4]2+中都存在配位键
 C.元素电负性越大的原子,吸引电子的能力越强
C.元素电负性越大的原子,吸引电子的能力越强

 D.原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性
D.原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性


 19-4(11分)
19-4(11分)
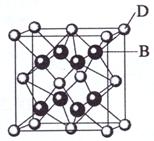
 已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第7列元素。D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如右图。
已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第7列元素。D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如右图。
 请回答:
请回答:
 (1)A元素的名称是 ;
(1)A元素的名称是 ;
 (2)B的元素符号是
,C的元素符号是
,B与A形成的化合物比C 与A形成的化合物沸点高,其原因是
(2)B的元素符号是
,C的元素符号是
,B与A形成的化合物比C 与A形成的化合物沸点高,其原因是
 (3)E属元素周期表中第
周期,第 族的元素,其元素名称是 , 它的+2价离子的电子排布式为
:
(3)E属元素周期表中第
周期,第 族的元素,其元素名称是 , 它的+2价离子的电子排布式为
:
 (4)从图中可以看出,D跟B形成的离子化合物的化学式为
;该离子化合 物晶体的密度为ag·cm-3,则晶胞的体积是
(只要求列出算式)。
(4)从图中可以看出,D跟B形成的离子化合物的化学式为
;该离子化合 物晶体的密度为ag·cm-3,则晶胞的体积是
(只要求列出算式)。
答案:
19-1
 B (3分)
B (3分)
19-2
 B(3分)
B(3分)
19-3
 A(3分)
A(3分)
19-4
 (11分)
(11分)
(1)  氢 (1分)
氢 (1分)
(2)  F
Cl 氟化氢分子间存在氢键,氯化氢分子间没有氢键(3分)
F
Cl 氟化氢分子间存在氢键,氯化氢分子间没有氢键(3分)
(3)  四 VIIB 锰
四 VIIB 锰  (4分)
(4分)
(4) 

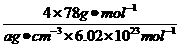 (3分)
(3分)
 可用于文物年代的鉴定,
可用于文物年代的鉴定, 互为同素异形体
互为同素异形体
 (3)三角锥
(3)三角锥 
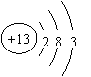 (1)X的单质既可与盐酸反应,又可与NaOH溶液反应,X为Al元素,X的原子结构示意图为
(1)X的单质既可与盐酸反应,又可与NaOH溶液反应,X为Al元素,X的原子结构示意图为 (3分)
(3分)  (3分)
(3分)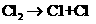 ②
② ③
③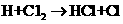 ……
……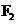 、
、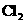 、
、 、
、 的顺序由难变易
的顺序由难变易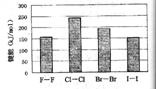 (4)卤素单质的键能大小如右图。由图推断:
(4)卤素单质的键能大小如右图。由图推断:

 非极性
非极性 37)[化学-选修化学与技术](15分)
37)[化学-选修化学与技术](15分)

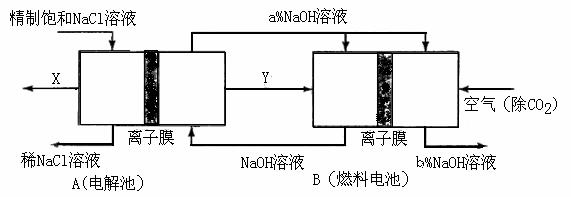 图中X、Y分别是_____、_______(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小_________;
图中X、Y分别是_____、_______(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小_________; (1)只要了解电解饱和食盐水的化学方程式2NaCl+2H2O 2NaOH+H2↑+Cl2↑即可得到,k=M(Cl2)/2 M(NaOH)=71/80=1:1.13或0.89;
(1)只要了解电解饱和食盐水的化学方程式2NaCl+2H2O 2NaOH+H2↑+Cl2↑即可得到,k=M(Cl2)/2 M(NaOH)=71/80=1:1.13或0.89;