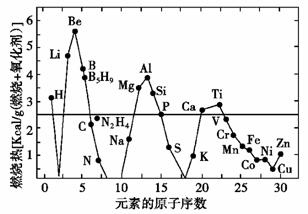
11.(2009年江苏单科)废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是_____(填字母)。
A.热裂解形成燃油
B.露天焚烧
C.作为有机复合建筑材料的原料
D.直接填埋
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s)+2H+(aq)===Cu2+(aq)+H2(g);ΔH=+64.39 kJ·mol-1
2H2O2(l)===2H2O(l)+O2(g);ΔH=-196.46 kJ·mol-1
H2(g)+O2(g)===H2O(l);ΔH=-285.84 kJ·mol-1
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为________________________________________________________________________。
(3)控制其他条件相同,印刷电路板的金属粉末用10%H2O2和3.0 mol·L-1 H2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
|
温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
|
铜平均溶解速率 (×10-3 mol·L-1·min-1) |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
当温度高于40 ℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是____________________________。
(4)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,制备CuCl的离子方程式是________________________________________________
________________________________________________________________________。
[解析] (1)B会引起大气污染;D会造成土壤、水体重金属污染。
(2)总方程式为Cu+H2O2+2H+===Cu2++2H2O,它可由题目提供的3个方程式得到,故ΔH=64.39+(-196.46)×+(-285.84)=-319.68 kJ·mol-1
故Cu(s)+H2O2(l)+2H+(aq)===Cu2+(aq)+2H2O(l);
ΔH=-319.68 kJ·mol-1。
[答案] (1)BD (2)Cu(s)+H2O2(l)+2H+(aq)===Cu2+(aq)+2H2O(l);ΔH=-319.68 kJ·mol-1
(3)H2O2分解速率加快
(4)2Cu2++SO+2Cl-+H2O2CuCl↓+SO+2H+
 Ca2+(aq)+2OH-(aq)向左移动,导致c(Ca2+)减小,溶液变浑浊。故符合题意的为B。
Ca2+(aq)+2OH-(aq)向左移动,导致c(Ca2+)减小,溶液变浑浊。故符合题意的为B。
 2-Na+
2-Na+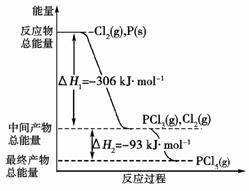 (2008年全国Ⅱ理综)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如右图所示(图中的ΔH表示生成1
mol产物的数据)。
(2008年全国Ⅱ理综)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如右图所示(图中的ΔH表示生成1
mol产物的数据)。