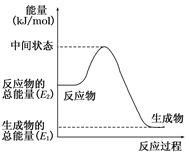
摘要:17.甲醇是人们开发和利用的一种新能源.已知:①2H2(g)+O2(g)===2H2O(l),ΔH1=-571.8 kJ/mol,②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g),ΔH2=-192.9 kJ/mol. (1)甲醇蒸气完全燃烧的热化学反应方程式为 . (2)反应②中的能量变化如图所示.则ΔH2= kJ/mol. (3)H2(g)的燃烧热为 . (4)请你分析H2(g)作为能源比甲醇蒸气作为能源的优点: . 解析:(1)根据盖斯定律.反应①+反应②有:2H2(g)+O2(g)+CH3OH(g)+1/2O2(g)===2H2O(l)+CO2(g)+2H2(g),ΔH=ΔH1+ΔH2=-571.8 kJ/mol-192.9 kJ/mol=-764.7 kJ/mol.则甲醇蒸气完全燃烧的热化学方程式为:CH3OH(g)+3/2O2(g)===CO2(g)+2H2O(l),ΔH=-764.7 kJ/mol. (2)反应的最终能量变化只与始态.终态能量有关.与中间状态无关.故ΔH2=E1-E2. (3)根据燃烧热的定义可知.H2(g)的燃烧热为-285.9 kJ/mol. (4)比较H2(g)和CH3OH(g)完全燃烧的热化学方程式.H2(g)燃烧产物为H2O.其对环境无任何影响.CH3OH(g)燃烧会产生对环境有影响的温室气体CO2.且等质量的H2(g)燃烧比CH3OH(g)燃烧放出的热量多. 答案:(1)CH3OH(g)+3/2O2(g)===CO2(g)+2H2O(l),ΔH=-764.7 kJ/mol (2)E1-E2 (3)-285.9 kJ/mol (4)H2燃烧的产物对环境无任何污染,等质量的H2完全燃烧放出的热量比CH3OH(g)的高
网址:http://m.1010jiajiao.com/timu3_id_84876[举报]
(8分)甲醇是人们开发和利用的一种新能源。已知:
①2H2(g)+O2(g)===2H2O(l) ΔH1=-571.8 kJ/mol;
②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g) ΔH2=-192.9 kJ/mol。
(1)甲醇蒸气完全燃烧的热化学反应方程式为__________________________。
(2)反应②中的能量变化如图所示,则ΔH2=________ kJ/mol(用E1、E2表示)。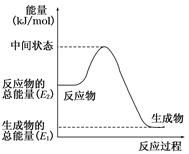
(3)H2(g)的燃烧热为________。
(4)请你分析H2(g)作为能源比甲醇蒸气作为能源的优点:______(写出两点即可)。