网址:http://m.1010jiajiao.com/timu3_id_84880[举报]
某厂的酸性工业废水中含有一定量的
Na+、Al3+、Fe3+、Cu2+、Cl-.该厂利用下图所示的工艺流程图,选用常见的气体氧化物、酸、碱和工业生产中的废铁屑,从废水中生产出了氯化铁、氧化铝、NaCl晶体和金属铜,产生了很好的社会经济效益.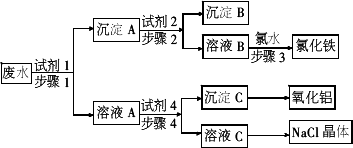
(1)试剂1是________.
(2)步骤1和步骤2所用的玻璃仪器是________.
(3)步骤1、3对应的离子方程式分别为________、________.
(4)步骤4中所加的试剂要便于控制反应,则步骤4的离子反应方程式为________.
某厂的酸性工业废水中含有一定量的Na+、Al3+、Fe3+、Cu2+、Cl-。该厂利用如图所示的工艺流程图,利用常见的气体氧化物、酸、碱和工业生产中的废铁屑,从废水中生产出了氯化铁、氧化铝、NaCl晶体和金属铜,产生了很好的社会经济效益。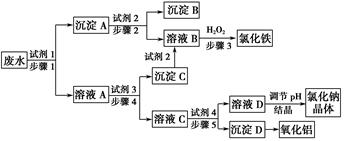
请填写下列空白:
(1)图中试剂1是________,试剂2是________。
(2)步骤1和步骤2所用到的玻璃仪器是________。
(3)步骤1反应的离子方程式为__________________________________。
(4)步骤3反应的离子方程式为__________________________________。
(5)从节约药品和环保方面考虑,步骤5所发生反应的离子方程式应为____________________________。
某厂的酸性工业废水中含有一定量的Na+、Al3+、 Fe3+、Cu2+、Cl-。该厂利用如图所示的工艺流程图,利用常见的气体氧化物、酸、碱和工业生产中的废铁屑,从废水中生产出了氯化铁、氧化铝、NaCl晶体和金属铜,产生了很好的社会经济效益。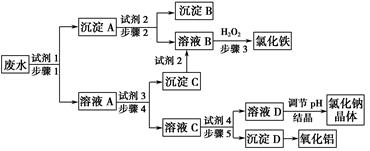
请填写下列空白:
(1)图中试剂1是________,试剂2是________。
(2)步骤1和步骤2所用到的玻璃仪器是________。
(3)步骤1反应的离子方程式为_______________________________________。
(4)步骤3反应的离子方程式为_______________________________________。
(5)从节约药品和环保方面考虑,步骤5所发生反应的离子方程式应为__________________________________________________________。
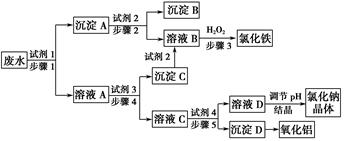
请填写下列空白:
(1)图中试剂1是________,试剂2是________。
(2)步骤1和步骤2所用到的玻璃仪器是________。
(3)步骤1反应的离子方程式为__________________________________。
(4)步骤3反应的离子方程式为__________________________________。
(5)从节约药品和环保方面考虑,步骤5所发生反应的离子方程式应为____________________________。