
[基础等级评价]
1.(2010·福建高考)下表各组物质中,满足下图物质一步转化关系的选项是( )
|
选项 |
X |
Y |
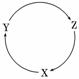 Z Z |
|
A |
Na |
NaOH |
NaHCO3 |
|
B |
Cu |
CuSO4 |
Cu(OH)2 |
|
C |
C |
CO |
CO2 |
|
D |
Si |
SiO2 |
H2SiO3 |
解析:本题考查元素化合物,意在考查考生对常见金属和非金属元素及其化合物相互转化的理解和分析能力.NaHCO3不能一步转化为Na,A项错误;Cu(OH)2不能一步转化为Cu,B项错误;根据CCOCO2C知,C项正确;H2SiO3不能一步转化为Si,D项错误.
答案:C
 2,CuSO4不能直接转化为CuO;选项D中SiO2不能直接转化为硅酸,硅酸钠也不能直接转化为二氧化硅.
2,CuSO4不能直接转化为CuO;选项D中SiO2不能直接转化为硅酸,硅酸钠也不能直接转化为二氧化硅. NO2具有还原性,能被O2氧化成NaNO3,故可以用NaNO2除去O2.
NO2具有还原性,能被O2氧化成NaNO3,故可以用NaNO2除去O2.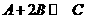 分别在三种不同实验条件下进行,它们的起始浓度均为
分别在三种不同实验条件下进行,它们的起始浓度均为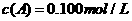 、
、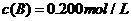 及
及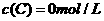 。反映物A的浓度随时间的变化如下图所示。
。反映物A的浓度随时间的变化如下图所示。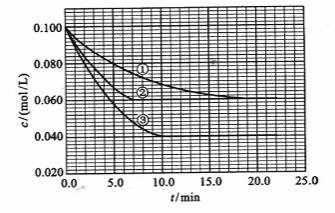
 _________0,判断其理由是____
_________0,判断其理由是____ ______________________________;
______________________________; 反应进行到4.0min时的平均反应速度率:
反应进行到4.0min时的平均反应速度率: =__________________________________;
=__________________________________; =__________________________________。
=__________________________________。 。对教学大纲和考纲以外的知识和技能,绝对不讲,不浪费学生复习时间,增加学生不必要的负担,如平衡常数、电离常数、电离度等有关计算。对于高考热点,反而要不惜时间、精力,全方位不间断地加以训练。如关于物质的量浓度的计算,不仅要讲计算,而且要和“一定物质的量浓度溶液的配制实验”结合起来,让学生亲身体会化学计算与实验、实际的联系;而且要和气体溶质如NH3的溶解、初中所学知识点物质的溶解度等知识结合起来,消除学生思维的盲点,拓展学生的思维,训练学生计算的基本技能。
。对教学大纲和考纲以外的知识和技能,绝对不讲,不浪费学生复习时间,增加学生不必要的负担,如平衡常数、电离常数、电离度等有关计算。对于高考热点,反而要不惜时间、精力,全方位不间断地加以训练。如关于物质的量浓度的计算,不仅要讲计算,而且要和“一定物质的量浓度溶液的配制实验”结合起来,让学生亲身体会化学计算与实验、实际的联系;而且要和气体溶质如NH3的溶解、初中所学知识点物质的溶解度等知识结合起来,消除学生思维的盲点,拓展学生的思维,训练学生计算的基本技能。 Y×98﹪×(32/9
Y×98﹪×(32/9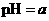 ,将此溶液稀释1倍后,溶液的
,将此溶液稀释1倍后,溶液的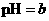 ,则
,则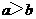
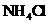 至溶液恰好无色,则此时溶液的
至溶液恰好无色,则此时溶液的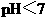
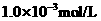 盐酸的
盐酸的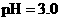 ,
,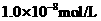 盐酸的
盐酸的
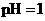 的盐酸与100mL
的盐酸与100mL 溶液混合后,溶液的
溶液混合后,溶液的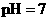 则
则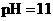
 ;
; 杂质的
杂质的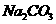 样品的纯度,现将
样品的纯度,现将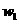 克样品加热,其质量变为
克样品加热,其质量变为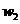 g,,则该样品的纯度(质量分数)是
g,,则该样品的纯度(质量分数)是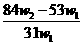 B.
B.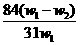 C.
C.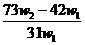 D.
D.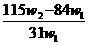
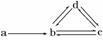
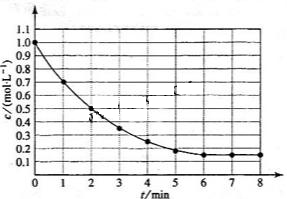 13.下图表示反应
13.下图表示反应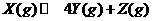 ,
,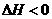 ,在某温度时
,在某温度时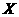 的浓度随时间变化的曲线:
的浓度随时间变化的曲线: 后,反应就终止了
后,反应就终止了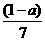 B.
B.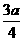 C.
C.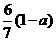 D.
D.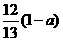
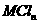 盐溶液中,恰好将溶液中的
盐溶液中,恰好将溶液中的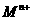 离子完全沉淀为碳酸盐,则
离子完全沉淀为碳酸盐,则