17.(8分)实验室 可用铝屑、氨水、氢氧化钠溶液、稀硫酸等来制备氢氧化铝,某同学设计了三种方案,
可用铝屑、氨水、氢氧化钠溶液、稀硫酸等来制备氢氧化铝,某同学设计了三种方案,
|
方 案 |
|
①Al―→Al3+―→Al(OH)3 |
②Al ―→AlO―→Al(OH)3 ―→AlO―→Al(OH)3 |
 |
(1)用方案①制备Al(OH)3时使用的药品最好是铝屑、稀硫酸和氨水,写出该方案中有关的离子方程式:______ ________________________________________________________.
________________________________________________________.
(2)用方案②来制备Al(OH)3时,必须注意________________的用量, 以防止生成的Al(OH)3溶解.
(3)完成下表
|
方案 |
生成1mol Al(OH)3消耗H+或OH-的物质的量/mol |
|
|
消耗H+ |
消耗OH- |
|
|
① |
3 |
|
|
② |
|
1 |
|
③ |
3/4 |
|
(4)三种方案中,你认为最好的是________(填序号),原因是________________________________________________________________________.
解析:(1)铝屑和稀硫酸反应生成硫酸铝和氢气,硫酸铝和氨水反应生成氢氧化铝和硫酸铵.
(2)稀硫酸过量,导致氢氧化铝溶解.
(3)(4)只要写出化学方程式,就能得出结论.
答案:(1)2Al+6H+===2Al3++3H2↑;
Al3++3NH3·H2O===Al(OH)3↓+3NH
(2)稀硫酸
(3)
|
方案 |
生成1mol Al(OH)3消耗H+或OH-的物质的量/mol |
|
|
消耗H+ |
消耗OH- |
|
|
|
|
|
|
① |
|
3 |
|
② |
1 |
|
|
③ |
|
3/4 |
(4)③ 药品用量最少

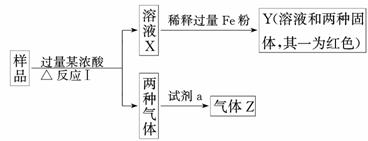
 析:由题干中框图转化的关系可知,Y中必含Cu,另有Fe2+.
析:由题干中框图转化的关系可知,Y中必含Cu,另有Fe2+.
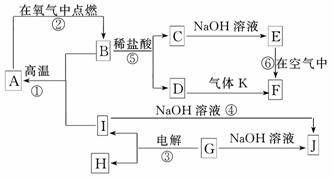
 D溶液中阳离子的方法_________________________________________.
D溶液中阳离子的方法_________________________________________. NH3·H2O+H+
NH3·H2O+H+