摘要:某温度下.相同pH值的盐酸和醋酸溶液分别加水稀释.pH值随溶液体积变化的曲线如图所示.据图判断正确的是( ) A.Ⅱ为盐酸稀释时的pH值变化曲线 B.b点溶液的导电性比c点溶液的导电性强 C.a点KW的数值比c点KW的数值大 D.b点酸的总浓度大于a点酸的总浓度 解析:两种酸起始pH相同.即c(H+)相同.说明:起始时.c远大于c,弱酸原来的c(H+)已等于强酸的c(H+).由于稀释使弱酸的电离度增大.所以在稀释的整个过程中.弱酸的c(H+)都大于强酸的c(H+).即pH是:弱酸<强酸.所以曲线Ⅱ是醋酸.Ⅰ是盐酸.A项错.由于在整个稀释过程中.醋酸的浓度始终大于盐酸的.所以D项错.溶液导电性强弱取决于离子浓度大小.对于酸而言.其pH越大.c(H+)越小.离子浓度越小.导电能力越弱.所以B项正确.KW的大小只取决于温度.与溶液的浓度无关.C项错. 答案:B
网址:http://m.1010jiajiao.com/timu3_id_84731[举报]
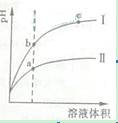 某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH 值随溶液体积
某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH 值随溶液体积![]() 变化的曲线如右图所示。据图判断正确的是( )
变化的曲线如右图所示。据图判断正确的是( )
![]() A.Ⅱ为盐酸稀释时pH值变化曲线
A.Ⅱ为盐酸稀释时pH值变化曲线
![]() B.b点溶液的导电性比c点溶液的导电性强
B.b点溶液的导电性比c点溶液的导电性强
![]() C.a点Ka的数值比c点Ku的数值大
C.a点Ka的数值比c点Ku的数值大
![]() D.b点酸的总浓度大于a点酸的总浓度
D.b点酸的总浓度大于a点酸的总浓度
某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如下图所示。据图判断正确的是( )

A.Ⅱ为盐酸稀释时的pH值变化曲线
B.b点溶液的导电性比c点溶液的导电性强
C.a点KW的数值比c点KW的数值大
D.b点酸的总浓度大于a点酸的总浓度
查看习题详情和答案>>某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积![]() 变化的曲线如右图所示。据图判断正确的是
变化的曲线如右图所示。据图判断正确的是
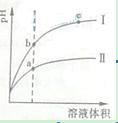
![]() A.Ⅱ为盐酸稀释时pH值变化曲线
A.Ⅱ为盐酸稀释时pH值变化曲线
![]() B.b点溶液的导电性比c点溶液的导电性强
B.b点溶液的导电性比c点溶液的导电性强
![]() C.a点Ka的数值比c点Ku的数值大
C.a点Ka的数值比c点Ku的数值大
![]() D.b点酸的总浓度大于a点酸的总浓度
D.b点酸的总浓度大于a点酸的总浓度
 某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积
某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积