摘要:22.(2010·长安一中.高新一中.交大附中.师大附中.西安中学第二次模拟考试)A.B.C三种强电解质.它们在水中电离出的离子如下表所示: 阳离子 Ag+ Na+ 阴离子 NO SO Cl- 下图所示装置中.甲.乙.丙三个烧杯依次分别盛放足量的A. B. C三种溶液.电极均为石墨电极.接通电源.经过一段时间后.测得乙中C电极质量增加了27克.常温下各烧杯中溶液的pH与电解时间t的关系图如下.据此回答下列问题: (1)M为电源的 极.甲 . (2)计算电极f上生成的气体在标准状况下的体积 . (3)写出乙烧杯的电解池反应 . (4)若电解后甲溶液的体积为25 L.则该溶液的pH为 . (5)要使丙恢复到原来的状态.应加入 g . 解析:接通电源.经过一段时间后.测得乙中C电极质量增加了27克.说明乙中溶质是硝酸银.Ag++e- =Ag.得到27克Ag.电路中通过的电子是0.25 mol. 结合图可知甲的pH增大是氯化钠.丙的pH不变是硫酸钠.电极f上生成的气体是O2, 0.25 mol 电子可电解水2.25 g.产生0.0625 mol O2. 答案:1.4 L (3) 4AgNO3+2H2O通电4Ag+O2↑+4HNO3
网址:http://m.1010jiajiao.com/timu3_id_84738[举报]
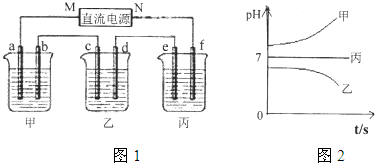
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
如图所示装置中,甲、乙、丙三个烧杯分别盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极.接通电源,经过一段时间后,测得乙中c电极质量增加了16g.常温下各烧杯中溶液的pH与电解时间t的关系如图.据此回答下列问题:

(1)M为电源的
(2)计算电极e上生成的气体在标准状况下的体积
(3)写出乙烧杯中发生电解的总反应化学方程式
(4)如果电解过程中B溶液中的金属离子全部析出,此时电解能否继续进行
(5)此时要使丙中溶液恢复到原来的状态,操作是
查看习题详情和答案>>
| 阳离子 | Na+、K+、Cu2+ | ||
| 阴离子 | SO
|

(1)M为电源的
负
负
极(填写“正”或“负”);电极b上发生的电极反应式为4OH--4e-=O2↑+2H2O
4OH--4e-=O2↑+2H2O
.(2)计算电极e上生成的气体在标准状况下的体积
5.6L
5.6L
.(3)写出乙烧杯中发生电解的总反应化学方程式
2CuSO4+2H2O
2Cu+O2↑+2H2SO4
| ||
2CuSO4+2H2O
2Cu+O2↑+2H2SO4
.
| ||
(4)如果电解过程中B溶液中的金属离子全部析出,此时电解能否继续进行
能
能
(填写“能”或“否”)原因为电解硫酸溶液
电解硫酸溶液
.(5)此时要使丙中溶液恢复到原来的状态,操作是
加入4.5g水
加入4.5g水
.A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、B、C三种溶液,电极均为石墨电极.
接通电源,经过一段时间后,测得乙中C电极质量增加了27克.常温下各烧杯中溶液的pH与电解时间t的关系图如图1.据此回答下列问题:

(1)M为电源的
(2)写出甲烧杯中反应的化学方程式
(3)有人设想用图2所示原电池为直流电源完成上述电解.则锌电极相当于直流电源的
(4)有人设想用图3所示装置做直流电源,不仅可以完成电解也能将气体SO2 转化为重要化工原料.该设想中负极的电极反应式为
查看习题详情和答案>>
| 阳离子 | Ag+ Na+ |
| 阴离子 | NO3- SO42- Cl- |
接通电源,经过一段时间后,测得乙中C电极质量增加了27克.常温下各烧杯中溶液的pH与电解时间t的关系图如图1.据此回答下列问题:

(1)M为电源的
负
负
极(填“正”或“负”);甲、乙电解质分别为NaCl
NaCl
、AgNO3
AgNO3
(填化学式).(2)写出甲烧杯中反应的化学方程式
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
| ||
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
.
| ||
(3)有人设想用图2所示原电池为直流电源完成上述电解.则锌电极相当于直流电源的
M
M
(填“M”或“N”)极.(4)有人设想用图3所示装置做直流电源,不仅可以完成电解也能将气体SO2 转化为重要化工原料.该设想中负极的电极反应式为
SO2+2H2O-2e-═4H++SO42-
SO2+2H2O-2e-═4H++SO42-
.(2012?山东模拟)A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
如图1所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极.

接通电源,经过一段时间后,测得乙中c电极质量增加了16g.常温下各烧杯中溶液的pH与电解时间t的关系图如图2.据此回答下列问题:
(1)M为电源的
电极b上发生的电极反应为
(2)计算电极e上生成的气体在标准状态下的体积:
(3)写出乙烧杯的电解池反应
(4)若经过一段时间后,测得乙中c电极质量增加了16g,要使丙恢复到原来的状态,加入的物质是
(5)如果电解过程中B溶液中的金属离子全部析出时,将电源电极反接,电解一段时间后,乙池中溶液的pH
查看习题详情和答案>>
| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | SO42-、OH- |

接通电源,经过一段时间后,测得乙中c电极质量增加了16g.常温下各烧杯中溶液的pH与电解时间t的关系图如图2.据此回答下列问题:
(1)M为电源的
负
负
极(填写“正”或“负”)电极b上发生的电极反应为
4OH--4e-=2H2O+O2↑
4OH--4e-=2H2O+O2↑
;(2)计算电极e上生成的气体在标准状态下的体积:
5.6L
5.6L
;(3)写出乙烧杯的电解池反应
2CuSO4+2H2O
2Cu+O2↑+2H2SO4
| ||
2CuSO4+2H2O
2Cu+O2↑+2H2SO4
| ||
(4)若经过一段时间后,测得乙中c电极质量增加了16g,要使丙恢复到原来的状态,加入的物质是
CuO
CuO
质量是20g
20g
.(5)如果电解过程中B溶液中的金属离子全部析出时,将电源电极反接,电解一段时间后,乙池中溶液的pH
不变
不变
(填“增大”“减小”或“不变”),电极d上的反应是Cu2++2e-=Cu
Cu2++2e-=Cu
.A、B、C三种强电解质,它们在水中电离出的离子如表所示:
 |
A、B、C三种强电解质,它们溶于水在水中电离出的阳离子有K+、Ag+,阴离子有NO3-、OH-(电解质电离的离子有重复).
图1装置中,甲、乙、丙三个烧杯中依次盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为铂电极.接通电源,经过一段时间后,测得甲中b电极质量增加了43.2g.常温下各烧杯中溶液pH与电解时间t关系如图2.请回答下列问题: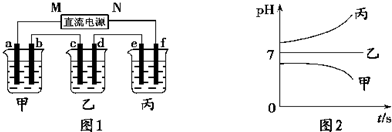
(1)写出三种强电解质的化学式:A
(2)写出乙烧杯c电极发生的电极反应为
(3)计算丙烧杯e电极上生成的气体在标准状况下的体积为
(4)要使甲烧杯中的A溶液恢复到电解前的状态,需要加入的物质是
(5)若直流电源使用的是铅蓄电池,铅蓄电池的正极材料是PbO2,负极材料是Pb,电解质溶液时H2SO4,则放电时N级上发生的电极反应为
查看习题详情和答案>>
图1装置中,甲、乙、丙三个烧杯中依次盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为铂电极.接通电源,经过一段时间后,测得甲中b电极质量增加了43.2g.常温下各烧杯中溶液pH与电解时间t关系如图2.请回答下列问题:

(1)写出三种强电解质的化学式:A
AgNO3
AgNO3
;BKNO3
KNO3
;CKOH
KOH
.(2)写出乙烧杯c电极发生的电极反应为
4OH--4e-=O2↑+2H2O
4OH--4e-=O2↑+2H2O
,甲烧杯中的总反应的化学方程式为4AgNO3
4Ag+O2↑+4HNO3
| ||
4AgNO3
4Ag+O2↑+4HNO3
.
| ||
(3)计算丙烧杯e电极上生成的气体在标准状况下的体积为
2.24L
2.24L
,甲烧杯中溶液体积为400ml,pH=0
0
.(4)要使甲烧杯中的A溶液恢复到电解前的状态,需要加入的物质是
Ag2O
Ag2O
,其质量为46.4g
46.4g
.(5)若直流电源使用的是铅蓄电池,铅蓄电池的正极材料是PbO2,负极材料是Pb,电解质溶液时H2SO4,则放电时N级上发生的电极反应为
Pb-2e-+SO42-=PbSO4
Pb-2e-+SO42-=PbSO4
,M级附近溶液的pH升高
升高
(选填“升高”或“降低”或“不变”).铅蓄电池充电时,若阳极和阴极之间用阳离子交换膜(只允许H+通过)隔开,则当外电路通过0.2mol电子时,由阳极室通过阳离子交换膜进入阴极室的阳离子有0.2
0.2
mol.