摘要:21.某同学利用下图所示方法制取一定浓度的双氧水.并且测定其质量分数. 请回答下列问题: (1)电解KHSO4饱和溶液时.阳极的电极反应式为 . (2)测定所得H2O2溶液的质量分数: ①移取10.00 mL H2O2溶液至250 mL 中.加水稀释至刻度.摇匀.移取稀释后的H2O2溶液25.00 mL至锥形瓶中.加入稀硫酸酸化.用蒸馏水稀释.作被测试样. ②用0.0100 mol/L高锰酸钾标准溶液滴定被测试样.其反应的离子方程式如下.请将相关物质的化学计量数填写在方框里. H++MnO+H2O2--Mn2++O2↑+H2O ③滴定时.高锰酸钾溶液应装在 .滴定到达终点的现象是 . ④上述操作②中.滴入第一滴KMnO4溶液.溶液紫红色消失很慢.随着滴定过程中Mn2+的增多.溶液紫红色消失速率迅速加快.则Mn2+作用的是 . ⑤若滴定前俯视读数.滴定后仰视读数.则测定结果 (填“偏高 .“偏低 或“不变 ). ⑥用同样方法滴定.三次消耗KMnO4溶液的体积分别为20.00 mL.19.98 mL.20.02 mL.则所得H2O2溶液的质量分数是 . 解析:本题利用KMnO4氧化双氧水的反应原理进行滴定来测定双氧水的质量分数.KMnO4溶液具有强氧化性.要用酸式滴定管来盛装.双氧水作为待测液要放在锥形瓶中.由于KMnO4溶液呈紫红色.刚好完全反应后呈无色.因此不需要滴加指示剂就可以进行终点判断. 根据6H++2MnO+5H2O2===2Mn2++5O2↑+8H2O可求得H2O2的物质的量是5×10-4 mol.进一步求得H2O2溶液的质量分数是1.7%. 答案:(1)2SO-2e-===S2O (2)①容量瓶 ②6 2 5 2 5 8 ③酸式滴定管 滴入一滴高锰酸钾溶液.溶液呈浅红色.且30秒内不褪色 ④催化剂 ⑤偏高 ⑥1.7%
网址:http://m.1010jiajiao.com/timu3_id_84737[举报]
某同学利用下图所示方法制取一定浓度的双氧水,并且测定其质量分数
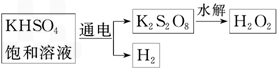
请回答下列问题:
(1)电解KHSO4饱和溶液时,阳极的电极反应式为___________________.
(2)测定所得H2O2溶液的质量分数:
①移取10.00 mL H2O2溶液(密度为1.00 g/mL)至250 mL ________(填仪器名称)中,加水稀释至刻度,摇匀.移取稀释后的H2O2溶液25.00 mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样.
②用0.0100 mol/L高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数填写在方框里.
(1)电解KHSO4饱和溶液时,阳极的电极反应式为___________________.
(2)测定所得H2O2溶液的质量分数:
①移取10.00 mL H2O2溶液(密度为1.00 g/mL)至250 mL ________(填仪器名称)中,加水稀释至刻度,摇匀.移取稀释后的H2O2溶液25.00 mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样.
②用0.0100 mol/L高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数填写在方框里.

③滴定时,高锰酸钾溶液应装在________.滴定到达终点的现象是__________________________________.
④上述操作②中,滴入第一滴KMnO4溶液,溶液紫红色消失很慢,随着滴定过程中Mn2+的增多,溶液紫红色消失速率迅速加快.则Mn2+作用的是________________________.
⑤若滴定前俯视读数,滴定后仰视读数,则测定结果________(填“偏高”、“偏低”或“不变”).
⑥用同样方法滴定,三次消耗KMnO4溶液的体积分别为20.00 mL、19.98 mL、20.02 mL.则所得H2O2溶液的质量分数是__________________.
查看习题详情和答案>>
④上述操作②中,滴入第一滴KMnO4溶液,溶液紫红色消失很慢,随着滴定过程中Mn2+的增多,溶液紫红色消失速率迅速加快.则Mn2+作用的是________________________.
⑤若滴定前俯视读数,滴定后仰视读数,则测定结果________(填“偏高”、“偏低”或“不变”).
⑥用同样方法滴定,三次消耗KMnO4溶液的体积分别为20.00 mL、19.98 mL、20.02 mL.则所得H2O2溶液的质量分数是__________________.