1.(1)(6分)磷酸(2分,写化学式给1分) C9H11O6P (2分) 4(或“四”,2分)
(2)(5分)10 (或“十”,3分) 2(或“二”,2分)
(3)原答案为:(4分)AD(对1个给2分,错1个0分)附:发生的反应和生成物如下:
|
所以(3)的评分细则修改为:AD给4分;只选A也给4分;错1个分。
3.(16分)有关钴和铁化合物的性质见下表
|
分子式 |
溶度积Ksp |
沉淀完全时的pH |
氯化钴晶体的性质 |
|
Co(OH)2 |
5.9×10-15 |
9.4 |
CoCl2·6H2O呈红色,常温下稳定。110-120℃时脱水变成蓝色无水氯化钴。 |
|
Fe(OH)2 |
1.6×10-14 |
9.6 |
|
|
Fe (OH)3 |
1.1×10-36 |
3.7 |
用含钴废料(含少量铁)可制备氯化钴:Co+2HCl=CoCl2+H2↑。工艺流程如下:
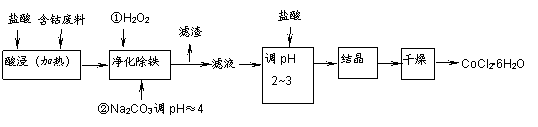
试回答:
 (1)“净化除铁”中,写出加入H2O2时反应的离子方程式 。
(1)“净化除铁”中,写出加入H2O2时反应的离子方程式 。
(2)②步中用Na2CO3调pH≈4的原因是 。
(3)“滤液”中所含主要溶质的化学式是 。
(4)为防止CoCl2·6H2O脱水,“干燥”时可采用的方法或操作是 。
.1.(1)(5分)2ZnS+3O2=====2ZnO+2SO2(3分) 6(2分)
(2)①(4分)写为Zn2+、ZnOH+或Zn(OH)2之中的两个都给分,每个2分
 ②(4分)Zn2++4OH-==Zn(OH)42- 或分步写:Zn2++2OH-==Zn(OH)2↓(2分)、Zn(OH)2+2OH- == Zn(OH)42-(2分)
②(4分)Zn2++4OH-==Zn(OH)42- 或分步写:Zn2++2OH-==Zn(OH)2↓(2分)、Zn(OH)2+2OH- == Zn(OH)42-(2分)
③(4分)由于在Zn(OH)2浊液存在溶解平衡:Zn(OH)2(s) Zn2+(aq)+2OH-(aq) (1分),而Ksp[Zn(OH)2]> Ksp(ZnS) (1分),滴入的S2-与Zn2+结合生成了更难溶(或溶度积更小)的ZnS,使Zn2+浓度减小,(1分)溶解平衡继续向右移动直至全部转化为ZnS(1分)。[合理叙述参照给分]
Zn2+(aq)+2OH-(aq) (1分),而Ksp[Zn(OH)2]> Ksp(ZnS) (1分),滴入的S2-与Zn2+结合生成了更难溶(或溶度积更小)的ZnS,使Zn2+浓度减小,(1分)溶解平衡继续向右移动直至全部转化为ZnS(1分)。[合理叙述参照给分]
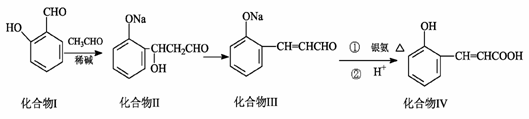
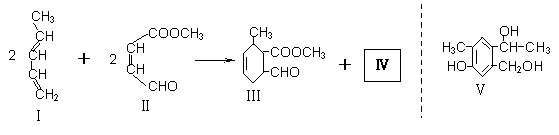
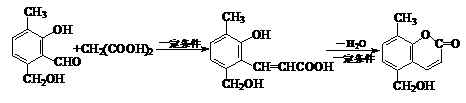
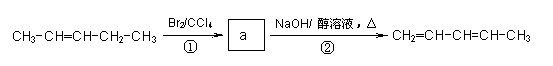 化合物Ⅰ可用石油裂解气中的2-戊烯来合成,流程如下:
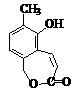
化合物Ⅰ可用石油裂解气中的2-戊烯来合成,流程如下: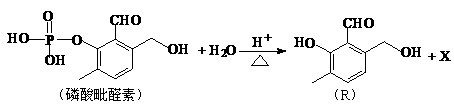 (15分)磷酸毗醛素是细胞的重要组成部分,可视为磷酸(分子中有3个羟基)形成的酯。它在酸性条件下水解反应为:
(15分)磷酸毗醛素是细胞的重要组成部分,可视为磷酸(分子中有3个羟基)形成的酯。它在酸性条件下水解反应为: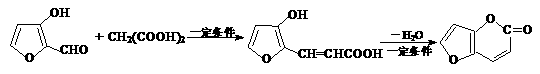 (3)已知反应:
(3)已知反应: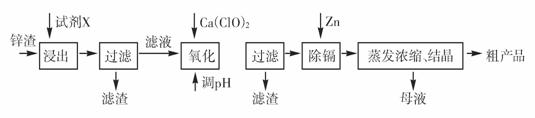
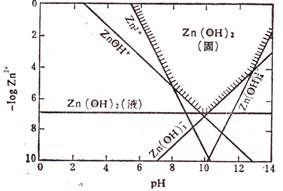 (2)已知Zn(OH)2具有两性,在过量的强碱性溶液中生成可溶于水的Zn(OH)42-。右图是Zn2+在某温度时水解、沉淀、溶解的曲线图。
(2)已知Zn(OH)2具有两性,在过量的强碱性溶液中生成可溶于水的Zn(OH)42-。右图是Zn2+在某温度时水解、沉淀、溶解的曲线图。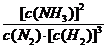 (3分);
< (2分);
② 0.45mol/(L·min) (3分); ③ C(2分)
(3分);
< (2分);
② 0.45mol/(L·min) (3分); ③ C(2分) NH3·HDO + D+(3分)
NH3·HDO + D+(3分)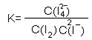 (4分)
(4分)