9.(原创)(14分)25℃时,有关弱酸的电离平衡常数如下:
|
弱酸化学式 |
CH3COOH |
HCN |
H2CO3 |
|
电离平衡常数(25℃) |
1.8×10-5 |
4.9×10-10 |
K1=4.3×10-7 K2=5.6×10-11 |
回答下列问题:
(1)等物质的量浓度的CH3COONa、NaHCO3、NaCN溶液中CH3COO-、HCO3-、CN-的大小关系为:
 (2)a mol/L NaOH溶液与b mol/LHCN溶液等体积混合后,所得溶液中c(Na+)=c(CN-),则a b(填>、<、=)
(3)在冰醋酸中逐滴加水,则溶液的导电性将如何变化
(2)a mol/L NaOH溶液与b mol/LHCN溶液等体积混合后,所得溶液中c(Na+)=c(CN-),则a b(填>、<、=)
(3)在冰醋酸中逐滴加水,则溶液的导电性将如何变化
醋酸的电离程度将如何变化
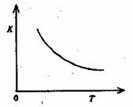
电离平衡常数将如何变化 (4)合成氨发生的反应为N2+3H2 2NH3。400"C时,该反应平衡常数K=0.5mol-2。·L2。已知该反应的平衡常数与温度的关系如图所示。500℃时,在 0.5L的定容容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别是2mol、1mol,2mol,则此时反应 V(N2)正 v(N2)逆
(填>、<、=或不能确定)。请书写判断理由
ww.k@s@5@ 高#考#资#源#网
10.(2010徐州一研18)(16分)高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
|
湿法 |
强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
|
干法 |
Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(1) 工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:
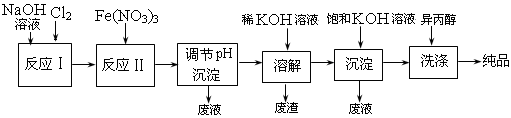
(2) ①反应I的化学方程式为
。
②反应II的离子方程式为
。
③加入饱和KOH溶液的目的是
。
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为
,__________。
(3)干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为 。
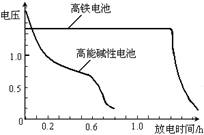
(4)高铁电池是正在研制中的可充电干电池,右图为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有 、 。
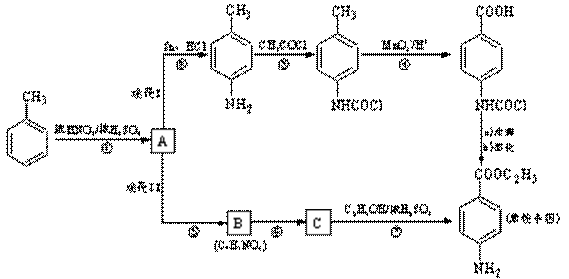 已知:①当苯环上连有甲基时,再引入的其他基团主要进入它的邻位或对位;当苯环上连有羧基时,再引入的其他基团主要进入它的间位。
已知:①当苯环上连有甲基时,再引入的其他基团主要进入它的邻位或对位;当苯环上连有羧基时,再引入的其他基团主要进入它的间位。
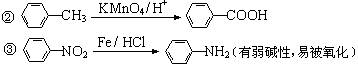 请回答下列问题:
(1)反应①的反应类型为______________,化合物B的结构简式为______________。
(2)反应⑦的化学方程式为__________________________________________________。
(3)下列关于上述合成路线的说法正确的是__________________。
a.反应①除了主要生成A物质外,还可能生成
请回答下列问题:
(1)反应①的反应类型为______________,化合物B的结构简式为______________。
(2)反应⑦的化学方程式为__________________________________________________。
(3)下列关于上述合成路线的说法正确的是__________________。
a.反应①除了主要生成A物质外,还可能生成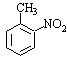 、
、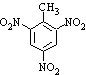 等
b.途径II中的步骤①和⑤可以互换
c.反应③的另一产物是H2Oww.k@s@5@
高#考#资#源#网
d.与途径II相比,途经I的缺点是步骤多,产率低
e.途经I中的步骤③的目的是保护氨基不被步骤④中的酸性高锰酸钾溶液氧化
(4)途经II中的步骤⑤和⑥能否互换,说明理由:_________________________________。
(5)苯佐卡因有多种同分异构体。请写出其中任意两种满足下列条件的同分异构体的结构简式:
①有两个对位取代基;②-NH2直接连在苯环上;③分子结构中含有酯基。__________________、 。
等
b.途径II中的步骤①和⑤可以互换
c.反应③的另一产物是H2Oww.k@s@5@
高#考#资#源#网
d.与途径II相比,途经I的缺点是步骤多,产率低
e.途经I中的步骤③的目的是保护氨基不被步骤④中的酸性高锰酸钾溶液氧化
(4)途经II中的步骤⑤和⑥能否互换,说明理由:_________________________________。
(5)苯佐卡因有多种同分异构体。请写出其中任意两种满足下列条件的同分异构体的结构简式:
①有两个对位取代基;②-NH2直接连在苯环上;③分子结构中含有酯基。__________________、 。 2SO3(g)
△H=-190kJ/ mol
7. (07海淀期中)在某无色溶液中,可能存在Na+、Ca2+、Fe3+、Br-、CO32-、SO42-、Cl-离子中的几种。某学生进行了下列实验:(1)取少量原溶液,在其中滴加足量氯水,有无色无味气体产生,溶液仍为无色,将溶液分为2份;(2)一份加入AgNO3溶液,有白色沉淀产生;(3)另一份加入BaCl2溶液,有白色沉淀产生。该溶液中一定大量存在的离子组是
A.Na+、Fe3+、SO42- B. Na+、SO42-、CO32-
C.Ca2+、Br-、SO42- D. CO32-、Cl-、SO42-
2SO3(g)
△H=-190kJ/ mol
7. (07海淀期中)在某无色溶液中,可能存在Na+、Ca2+、Fe3+、Br-、CO32-、SO42-、Cl-离子中的几种。某学生进行了下列实验:(1)取少量原溶液,在其中滴加足量氯水,有无色无味气体产生,溶液仍为无色,将溶液分为2份;(2)一份加入AgNO3溶液,有白色沉淀产生;(3)另一份加入BaCl2溶液,有白色沉淀产生。该溶液中一定大量存在的离子组是
A.Na+、Fe3+、SO42- B. Na+、SO42-、CO32-
C.Ca2+、Br-、SO42- D. CO32-、Cl-、SO42-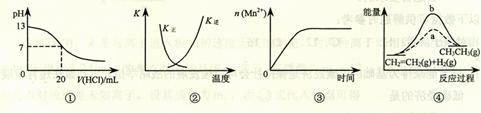
 2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化