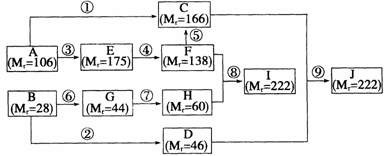
7.常温下,对下列四种溶液的叙述正确的是
|
|
① |
② |
③ |
④ |
|
溶液 |
氨水 |
氢氧化钠溶液 |
醋酸溶液 |
盐酸 |
|
pH |
10 |
10 |
4 |
4 |
A.②、④两溶液相比,两者的kw不相同
B.四种溶液分别加水稀释10倍,pH变化最大的是①和④
C.①、②、③中分别加入少量的醋酸铵固体后,三种溶液的pH均减小
D.①、④ 两溶液按一定体积比混合,所得溶液中离子浓度的关系一定有:
c(NH4+)+c(H+)=c(Cl-)+c(OH-)
13、把一定量的Na2O2的NaHCO3的混合粉末分为两等份,将其中一份加入100mL稀盐酸中恰好完全反应,生成的气体干燥后体积为2.24L(标准状况下);再将此气体通入另一份混合物中,充分反应后,得到O2 2.016L(标准状况下),则原混合粉末中Na2O2和NaHCO3的物质的量之比及稀盐酸的物质的量浓度是( )
|
|
A |
B |
C |
D |
|
Na2O2和NaHCO3的物质的量之比 |
8:1 |
9:2 |
8:1 |
2:9 |
|
原稀盐酸的物质的量的浓度(mol·L-1) |
3.4 |
1.1 |
1.8 |
1.3 |
第Ⅱ卷(非选择题,共58分)
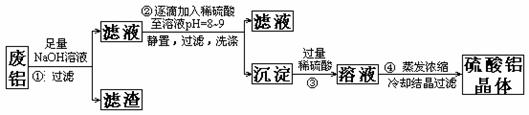
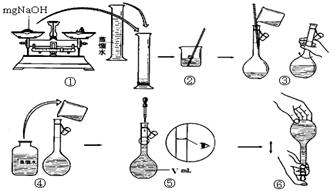
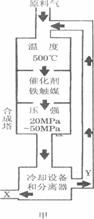 (15分)(1)合成氨工业对化学工业和国防工业具有重要意义。工业合成氨生产示意图如图甲所示。
(15分)(1)合成氨工业对化学工业和国防工业具有重要意义。工业合成氨生产示意图如图甲所示。 图甲中条件选定的主要原因是(选填字母序号,下同)____________。
图甲中条件选定的主要原因是(选填字母序号,下同)____________。 ②改变反应条件,会使平衡发生移动。图乙表示随条件改变,氨气的百分含量的变化趋势。当横坐标为压强时,变化趋势正确的是________,当横坐标为温度时,变化趋势正确的是__________。
②改变反应条件,会使平衡发生移动。图乙表示随条件改变,氨气的百分含量的变化趋势。当横坐标为压强时,变化趋势正确的是________,当横坐标为温度时,变化趋势正确的是__________。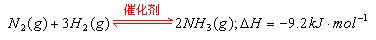 ,向一个容积不变的容器中,加入1 mol N2和4mol H2及固体催化剂,使之反应。平衡时容器内气体压强为起始时的80%。则达到平衡时,放出的热量为 。
,向一个容积不变的容器中,加入1 mol N2和4mol H2及固体催化剂,使之反应。平衡时容器内气体压强为起始时的80%。则达到平衡时,放出的热量为 。
 2H2O
2H2O