6.(原创)下述实验能达到预期目的的是
|
编号 |
实验内容 |
实验目的 |
|
A |
在滴有酚酞的Na2CO3溶液中, 加入CaC12溶液后红色褪去 |
验证Na2CO3溶液中存在水解平衡 |
|
B |
将SO2通入中KMnO4溶液中 |
验证SO2具有漂白性 |
|
C |
淀粉溶液和稀H2SO4混合加热,后加新制的Cu(OH)2悬浊液加热至沸腾 |
检验淀粉水解产物有还原性 |
|
D |
将乙醇与浓硫酸共热制得的气体通入酸性KMnO4溶液中 |
检验气体中含有乙烯 |
9.(原创)(14分)25℃时,有关弱酸的电离平衡常数如下:
|
弱酸化学式 |
CH3COOH |
HCN |
H2CO3 |
|
电离平衡常数(25℃) |
1.8×10-5 |
4.9×10-10 |
K1=4.3×10-7 K2=5.6×10-11 |
回答下列问题:
(1)等物质的量浓度的CH3COONa、NaHCO3、NaCN溶液中CH3COO-、HCO3-、CN-的大小关系为:
 (2)a mol/L NaOH溶液与b mol/LHCN溶液等体积混合后,所得溶液中c(Na+)=c(CN-),则a b(填>、<、=)
(3)在冰醋酸中逐滴加水,则溶液的导电性将如何变化
(2)a mol/L NaOH溶液与b mol/LHCN溶液等体积混合后,所得溶液中c(Na+)=c(CN-),则a b(填>、<、=)
(3)在冰醋酸中逐滴加水,则溶液的导电性将如何变化
醋酸的电离程度将如何变化
电离平衡常数将如何变化 (4)合成氨发生的反应为N2+3H2 2NH3。400"C时,该反应平衡常数K=0.5mol-2。·L2。已知该反应的平衡常数与温度的关系如图所示。500℃时,在 0.5L的定容容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别是2mol、1mol,2mol,则此时反应 V(N2)正 v(N2)逆
(填>、<、=或不能确定)。请书写判断理由
10.(2010徐州一研18)(16分)高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
|
湿法 |
强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
|
干法 |
Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
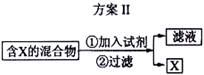
(1) 工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:
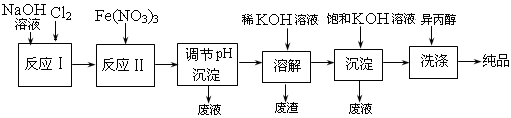
(2) ①反应I的化学方程式为
。
②反应II的离子方程式为
。
③加入饱和KOH溶液的目的是
。
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为
,__________。
(3)干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为 。
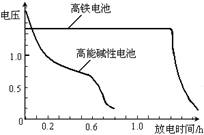
(4)高铁电池是正在研制中的可充电干电池,右图为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有 、 。

 还原型(无色)
还原型(无色)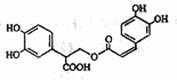 如下图所示。下列叙述正确的是 ( )
如下图所示。下列叙述正确的是 ( )
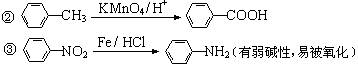
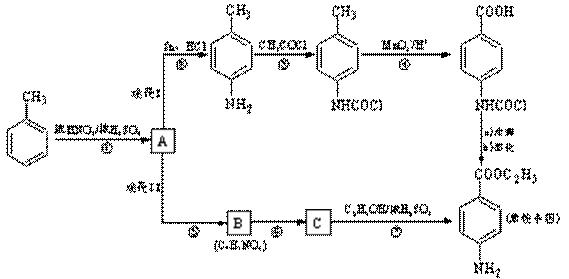 已知:①当苯环上连有甲基时,再引入的其他基团主要进入它的邻位或对位;当苯环上连有羧基时,再引入的其他基团主要进入它的间位。
已知:①当苯环上连有甲基时,再引入的其他基团主要进入它的邻位或对位;当苯环上连有羧基时,再引入的其他基团主要进入它的间位。
 请回答下列问题:
(1)反应①的反应类型为______________,化合物B的结构简式为______________。
(2)反应⑦的化学方程式为__________________________________________________。
(3)下列关于上述合成路线的说法正确的是__________________。
a.反应①除了主要生成A物质外,还可能生成
请回答下列问题:
(1)反应①的反应类型为______________,化合物B的结构简式为______________。
(2)反应⑦的化学方程式为__________________________________________________。
(3)下列关于上述合成路线的说法正确的是__________________。
a.反应①除了主要生成A物质外,还可能生成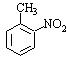 、
、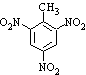 等
b.途径II中的步骤①和⑤可以互换
c.反应③的另一产物是H2O
d.与途径II相比,途经I的缺点是步骤多,产率低
e.途经I中的步骤③的目的是保护氨基不被步骤④中的酸性高锰酸钾溶液氧化
(4)途经II中的步骤⑤和⑥能否互换,说明理由:_________________________________。
(5)苯佐卡因有多种同分异构体。请写出其中任意两种满足下列条件的同分异构体的结构简式:
①有两个对位取代基;②-NH2直接连在苯环上;③分子结构中含有酯基。__________________、 。
等
b.途径II中的步骤①和⑤可以互换
c.反应③的另一产物是H2O
d.与途径II相比,途经I的缺点是步骤多,产率低
e.途经I中的步骤③的目的是保护氨基不被步骤④中的酸性高锰酸钾溶液氧化
(4)途经II中的步骤⑤和⑥能否互换,说明理由:_________________________________。
(5)苯佐卡因有多种同分异构体。请写出其中任意两种满足下列条件的同分异构体的结构简式:
①有两个对位取代基;②-NH2直接连在苯环上;③分子结构中含有酯基。__________________、 。