30.[化学--物质结构与性质(13分)
现有部分前四周期元素的性质或原子结构如下表:
|
元素编号 |
元素性质或原子结构 |
|
A |
第三周期中的半导体材科 |
|
B |
L层s电子数比p电子数少l |
|
C |
地壳中含量最高的元素 |
|
D |
第三周期主族元素中其第一电离能最大 |
|
E |
第四周期中未成对电子数最多 |
( 1)写出元素E基态原子的电子排布式: 。
(2)B单质分子中,含有
个 键和
个
键和
个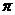 键,元素B的气态氢化的空间构型为
。
键,元素B的气态氢化的空间构型为
。
(3)A、B、C第一电离由大到小的顺序为(用元素符号表示): ;
(4)C单质的熔点 A单质的熔点(填“高于”或“低于”),其原因是:
。
25.(17分)已知:将KI、盐酸、试剂X和淀粉四种溶液混合,无反应发生。若再加入双氧水,将发生反应:H2O2+2H++2I-→2H2O+I2,且生成的I2立即与试剂X反应而被消耗。一段时间后,试剂X将被反应生成的I2完全消耗。由于溶液中的I-继续被H2O2氧化,生成的I2与淀粉作用,溶液立即变蓝。因此,根据试剂X的量、滴入双氧水至溶液变蓝所需的时间,即可推算反应H2O2+2H++2I-→2H2O+I2的反应速率。
下表为某同学依据上述原理设计的实验及实验记录(各实验均在室温条件下进行):
|
编号 |
往烧杯中加入的试剂及其用量(mL) |
催化剂 |
溶液开始变蓝时间(min) |
||||
|
0.1 mol·L-1 KI溶液 |
H2O |
0.01 mol·L-1 X 溶液 |
0.1 mol·L-1 双氧水 |
1 mol·L-1 稀盐酸 |
|||
|
1 |
20.0 |
10.0 |
10.0 |
20.0 |
20.0 |
无 |
1.4 |
|
2 |
20.0 |
m |
10.0 |
10.0 |
n |
无 |
2.8 |
|
3 |
10.0 |
20.0 |
10.0 |
20.0 |
20.0 |
无 |
2.8 |
|
4 |
20.0 |
0 |
10.0 |
10.0 |
40.0 |
无 |
t |
|
5 |
20.0 |
10.0 |
10.0 |
20.0 |
20.0 |
5滴Fe2(SO4)3 |
0.6 |
回答下列问题:
(1)已知:实验1、2的目的是探究H2O2浓度对H2O2+2H++2I-→2H2O+I2反应速率的影响。实验2中m= ,n=
(2)已知,I2与X反应时,两者物质的量之比为1:2。实验3从开始至反应进行到2.8min时,此段时间内H2O2+2H++2I-→2H2O+I2反应速率v(I-)=_________________。
(3)一定温度下,H2O2+2H++2I-→2H2O+I2反应速率可以表示为v=k·c a(H2O2)·c b (I-)·c(H+)(k为常数),则:
①实验4时,烧杯中溶液开始变蓝的时间t=___________。
②根据上表数据可知,a、b的值依次为 和 。
(4)实验5表明:硫酸铁能提高反应速率。
①催化剂能加快反应速率是因为催化剂 (填“提高”或“降低”)了反应活化能。
②试用离子方程式表示Fe2(SO4)3对H2O2+2H++2I-→2H2O+I2催化的过程。
、 (不必配平)
(5)若要探究温度对H2O2+2H++2I-→2H2O+I2反应速率的影响,为了避免温度过高导致双氧水大量分解,应该采取的加热方式是 。
选考部分
第II卷选考部分共5小题,共35分。其中,第28、29题为物理题,第30、31题为化学题,考生从两道物理题、两道化学题中各任选一题作答,若第28、29题都作答,则按第28题计分,若第30、31题都作答,则按第30题计分;第32题为生物题,是必答题。请将答案都填写在答题卡选答区域的指定位置上。
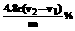 (3分)
(3分) [化学--有机化学基础](13分)
[化学--有机化学基础](13分) 格氏试剂(RMgX)是有机反应中的一种重要试剂,它的制法为:Rx+Mg RMgX(R为烃基,X为卤素)格氏试剂能与醛反应生成醇,反应历程为:
格氏试剂(RMgX)是有机反应中的一种重要试剂,它的制法为:Rx+Mg RMgX(R为烃基,X为卤素)格氏试剂能与醛反应生成醇,反应历程为: 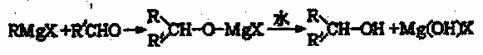
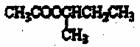 的过程如下(反应条件没有列出):
的过程如下(反应条件没有列出):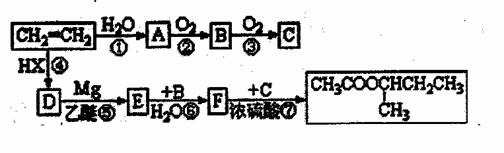

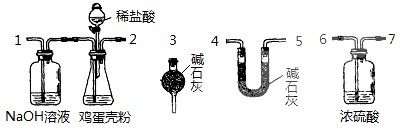 (3)如果鸡蛋壳粉质量为mg,溶液中Y2+浓度为c mol/L,则鸡蛋壳样品中镁元素质量分数是
。
(3)如果鸡蛋壳粉质量为mg,溶液中Y2+浓度为c mol/L,则鸡蛋壳样品中镁元素质量分数是
。
 TiCl4(l) + O2
(g) △H = +151 kJ·mol-1
TiCl4(l) + O2
(g) △H = +151 kJ·mol-1