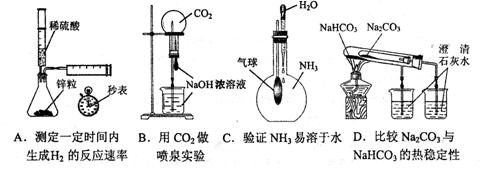
2.(2011朝阳区26.)(16分)
为减小CO2对环境的影响,在限制其排放量的同时,应加强对CO2创新利用的研究。
 (1)① 把含有较高浓度CO2的空气通入饱和K2CO3溶液。
(1)① 把含有较高浓度CO2的空气通入饱和K2CO3溶液。
② 在①的吸收液中通高温水蒸气得到高浓度的CO2气体。
写出②中反应的化学方程式 。
(2)如将CO2与H2 以1:3的体积比混合。
①适当条件下合成某烃和水,该烃是 (填序号)。
A.烷烃 B.烯烃 C.炔烃 D.苯的同系物
② 适当条件下合成燃料甲醇和水。在体积为2L的密闭容器中,充入2 mol CO2和6 mol H2,一定条件下发生反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g) △H=-49.0 kJ/mol。
CH3OH(g)+H2O(g) △H=-49.0 kJ/mol。
测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
从反应开始到平衡,v(H2)= ;氢气的转化率= ;能使平衡体系中n(CH3OH)增大的措施有 。
(3)如将CO2与H2 以1:4的体积比混合,在适当的条件下可制得CH4。
已知:
CH4 (g) + 2O2(g)
 CO2(g)+
2H2O(l) ΔH1=― 890.3 kJ/mol
CO2(g)+
2H2O(l) ΔH1=― 890.3 kJ/mol
H2(g) + 1/2O2(g)  H2O(l) ΔH2=-285.8 kJ/mol
H2O(l) ΔH2=-285.8 kJ/mol
则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式是 。
(4)某同学用沉淀法测定含有较高浓度CO2的空气中CO2的含量,经查得一些物质在20℃的数据如下表。
|
溶解度(S)/g |
溶度积(Ksp) |
||
|
Ca(OH)2 |
Ba(OH)2 |
CaCO3 |
BaCO3 |
|
0.16 |
3.89 |
2.9×10-9 |
2.6×10-9 |
(说明:Ksp越小,表示该物质在水溶液中越易沉淀)
吸收CO2最合适的试剂是 [填“Ca(OH)2”或“Ba(OH)2”]溶液,实验时除需要测定工业废气的体积(折算成标准状况)外,还需要测定 。
答案 26.(16分)
(1)② 2KHCO3 K2CO3+H2O+CO2↑
K2CO3+H2O+CO2↑
(2)① B
② v(H2)=0.24 mol/(L·min) 80%
降低温度(或加压或增大H2的量等)
(3)CO2(g) + 4H2(g)  CH3OH
(g)+ 2H2O(l) ΔH1= +318.7 kJ/mol
CH3OH
(g)+ 2H2O(l) ΔH1= +318.7 kJ/mol
(4)Ba(OH)2 BaCO3的质量
1.(2011朝阳区12.)已知:2CH3OH(g)
 CH3OCH3(g)
+ H2O(g) ΔH=-25 kJ/mol 某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下:
CH3OCH3(g)
+ H2O(g) ΔH=-25 kJ/mol 某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下:
|
物质 |
CH3OH |
CH3OCH3 |
H2O |
|
c/(mol·L-1) |
0.8 |
1.24 |
1.24 |
下列说法正确的是
A. 平衡后升高温度,平衡常数>400
B.平衡时,c(CH3OCH3)=1.6 mol/L
C. 平衡时,反应混合物的总能量减少20 kJ
D. 平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率增大
33.(16分)下面是某同学检验海水中溴离子的实验,请你参与他的探究:
(1)由于溴离子在海水中浓度很低(0.067g/L),要先取海水样品(设取70mL)进行浓缩,浓缩时下面的仪器 是不需要的(填编号):
A.玻璃棒 B.三脚架 C.酒精灯 D.蒸发皿 E.100mL烧杯
(2)取浓缩后的海水(假设剩余10mL左右)进行氧化和萃取。
① 下列试剂都可以氧化浓缩后海水中的溴离子,实验中最好选 (填编号):
A.氯水 B.双氧水 C.酸性高锰酸钾溶液
②加入一定量氧化剂后,对氧化后的溶液进行假设和实验:
假设1:溶液中全部为Br-; 假设2:溶液全部为Br2
假设3:溶液中 。
③设计方案、进行实验,验证假设:请在表中写出实验步骤以及预期现象和结论(可以不填满)。限选实验试剂和仪器:10mL量筒、小烧杯、试管、胶头滴管、分液漏斗;无水乙醇、裂化汽油、苯、0.10mol/LAgNO3、0.10mol/LHNO3
|
实验步骤 |
预期现象和结论 |
|
步骤1:用量筒取样品溶液6mL于试管中,再取
|
若上层有机层出现橙色或橙红色,则假设2或假设3成立;
|
|
步骤2:将上述液体倒入
|
|
31.(16分) 二甲醚(CH3OCH3)被称为21世纪的清洁、高效能源。
(1)合成二甲醚反应一:3H2(g) + 3CO(g)  CH3OCH3(g)
+ CO2(g) ΔH=-247kJ/mol
CH3OCH3(g)
+ CO2(g) ΔH=-247kJ/mol
一定条件下该反应在密闭容器中达到平衡后,要提高CO的转化率,可以采取的措施是 。
A.低温高压 B.加催化剂 C.体积不变充入N2 D.增加CO浓度 E.分离出二甲醚
(2)合成二甲醚反应二:2CH3OH(g) CH3OCH3(g)
+ H2O(g)。在某温度下,在1L密闭容器中加入CH3OH ,反应到10分钟时达到平衡,此时测得各组分的浓度如下:
CH3OCH3(g)
+ H2O(g)。在某温度下,在1L密闭容器中加入CH3OH ,反应到10分钟时达到平衡,此时测得各组分的浓度如下:
|
物 质 |
CH3OH |
CH3OCH3 |
H2O |
|
浓度/mol·L-1 |
0.01 |
0.2 |
0.2 |
 ①该温度的平衡常数为
。
①该温度的平衡常数为
。
②10 min内平均反应速率v(CH3OH) = ;
(3)右图为绿色电源“二甲醚燃料电池” 的工作
原理示意图。该反应的还原剂是 (写名称);
若b电极的反应式为:3O2+12e-+12H+==6H2O,则a电
极的反应式为: 。
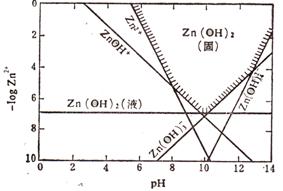 (2)已知Zn(OH)2具有两性,在过量的强碱性溶液中生成可溶于水的Zn(OH)42-。右图是Zn2+在某温度时水解、沉淀、溶解的曲线图。
(2)已知Zn(OH)2具有两性,在过量的强碱性溶液中生成可溶于水的Zn(OH)42-。右图是Zn2+在某温度时水解、沉淀、溶解的曲线图。 (15分)磷酸毗醛素是细胞的重要组成部分,可视为磷酸(分子中有3个羟基)形成的酯。它在酸性条件下水解反应为:
(15分)磷酸毗醛素是细胞的重要组成部分,可视为磷酸(分子中有3个羟基)形成的酯。它在酸性条件下水解反应为: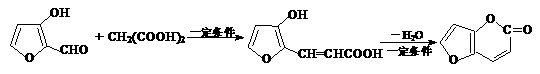 (3)已知反应:
(3)已知反应: