23. (17分)甲醇被称为21世纪的新型燃料,工业上用CH4和H2O为原料通过下列反应①和②,来制备甲醇。
(17分)甲醇被称为21世纪的新型燃料,工业上用CH4和H2O为原料通过下列反应①和②,来制备甲醇。
①CH4(g)+H2O(g) CO(g)+3H2(g) DH1
CO(g)+3H2(g) DH1
②CO(g)+2H2(g) CH3OH(g) DH2
CH3OH(g) DH2
将0.20 mol CH4和0.30 mol H2O(g)通入容积为10 L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度、压强的关系如右图。
⑴温度不变,缩小体积,①的逆反应速率 (填“增大”、“减小”或“不变”)。
⑵反应①的DH1 0(填“<”“=”或“>”)100°C时的平衡常数值K= 。
⑶在压强为0.1Mpa条件下,将amolCO与3amolH2的混合气体在催化剂作用下进行反应②再生成甲醇。为了发寻找合成甲醇的适宜的温度和压强,某同学设计了二组实验,部分实验条件已经填在下面实验设计表中。请在空格中填入剩余的实验条件数据。
|
实验编号 |
T(°C) |
n(CO)/n(H2) |
p(MPa) |
|
I |
150 |
1/3 |
0.1 |
|
II |
|
|
5 |
|
III |
350 |
|
5 |
300°C时,其他条件不变,将容器的容积压缩到原来的1/2,对平衡体系产生的影响是(填字母)( )
A.c(H2)减少 B.正反应速率加快,逆反应速率减慢
C.CH3OH的物质的量增加 D.重新平衡时c(H2)/c(CH2OH)减小
⑷已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)DH=-1275.6 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) DH=-556.0 kJ·mol-1
③H2O(g)=H2O(l)DH=-44.0 kJ·mol-1
 写出甲醇不完全燃烧生成一氧化碳的液态水的热化学方程式
。
写出甲醇不完全燃烧生成一氧化碳的液态水的热化学方程式
。
⑸某实验小组依据甲醇燃烧的反应原理,设计如右图所示的电池装置。
①该电池正极的电极反应为 。
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为
。
[答案]⑴增大 ⑵> 1.35×10-3
⑶CD 实验II 150 1/3 实验III 1/3
⑷CH3OH(l)+O2(g) CO(g)+2H2O(g) DH= -447.8 kJ·mol-1
CO(g)+2H2O(g) DH= -447.8 kJ·mol-1
⑸①O2+2H2O+4e-=4OH- 2CH3OH+3O2+4KOH=2K2CO3+6H2O
[解析]⑴缩小容器的容积,导致压强增大,正逆反应速率均加快。⑵由题中图像知温度升高,CH4的转化率变大,说明该反应的正反应为吸热反应。
在100℃时,CH4的转化率为0.5,则有
CH4(g)+H2O(g)CO(g)+3H2(g)
起始:0.2mol 0.3mol 0 0
变化:0.1mol 0.1mol 0.1mol 0.3mol
平衡:0.1mol 0.2mol 0.1mol 0.3mol
K=c(CO)×c(H2)3/[c(CH4)×c(H2O)]=0.01×0.033/(0.01×0.02)=1.35×10-3。
⑶显然该同学通过“控制变量法”探究外界条件对化学平衡的影响,探究的前提只能是改变一个条件,而其它条件不变,故实验II的温度是150℃,n(CO)/n(H2)=1/3,同样实验III中n(CO)/n(H2)同样等于1/3。
由于反应CO(g)+2H2(g) CH3OH(g)是气体体积减小的反应,现体积缩小,即增大压强,反应物和生成物的浓度均增大,正逆反应速率均加快,化学平衡向正反应方向移动,综上分析,选项C和D正确。
CH3OH(g)是气体体积减小的反应,现体积缩小,即增大压强,反应物和生成物的浓度均增大,正逆反应速率均加快,化学平衡向正反应方向移动,综上分析,选项C和D正确。
⑷根据盖斯定律得(①-②+③×4)/2得CH3OH(l)+O2(g) CO(g)+2H2O(g) DH= -447.8 kJ·mol-1。
CO(g)+2H2O(g) DH= -447.8 kJ·mol-1。
⑸根据题意该原电池反应的总反应式为2CH3OH+3O2+4KOH=2K2CO3+6H2O,故导致溶液的pH减小。
[考点]化学反应速率与化学平衡 电解质溶液
22.(11分) I.实验室有一瓶失去标签的某白色固体,已知其成份可能是碳酸或亚硫酸的钠盐或钾盐,
且其成分单一。现某化学小组通过如下步骤来确定其成分:
⑴阳离子的确定:
实验方法及现象: 。
结论:此白色固体是钠盐。
⑵阴离子的确定:
①取少量白色固体于试管中,然后向试管中加入稀盐酸,白色固体全部溶解,产生无色气体,此气体能使溴水褪色。
②要进一步确定其成分需补做如下实验:取适量白色固体配成溶液,取少许溶液于试管中,加入BaCl2溶液,出现白色沉淀。
II.确认其成分后,由于某些原因,此白色固体部分被空气氧化,该化学小组想用已知浓度的酸性KMnO4溶液来确定变质固体中X的含量,具体步骤如下:
步骤I 称取样品1.000 g。
步骤II 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤III 移取25.00 mL样品溶液于250 mL锥形瓶中,用0.01 mol·L-1 KMnO4标准溶液滴定至终点。
按上述操作方法再重复2次。
⑴写出步骤III所发生反应的离子方程式 。
⑵在配制0.01 mol·L-1 KMnO4溶液时若仰视定容,则最终测得变质固体中X的含量 (填“偏大”、“偏小”或“无影响”)
⑶滴定结果如下表所示:
|
滴定次数 |
待测溶液的体积/mL |
标准溶液的体积 |
|
|
滴定前刻度/mL |
滴定后刻度/mL |
||
|
1 |
25.00 |
1.02 |
21.03 |
|
2 |
25.00 |
2.00 |
21.99 |
|
3 |
25.00 |
2.20 |
20.20 |
则该变质固体中X的质量分数为 。
[答案]I.⑴取固体少许,进行焰色反应实验,焰色为黄色,则含Na+。
II.⑴2MnO4-+5SO32-+6H+=2Mn2++5SO42-+3H2O ⑵偏大 ⑶63%
[解析]题中一个关键点是白色固体成分单一,由阳离子检验可知该盐是钠盐,由实验II①可知该盐是亚硫酸盐或亚硫酸氢盐,由实验II②可排除该盐是亚硫酸氢盐,该盐应是Na2SO3,Na2SO3易在空气中被氧化生成Na2SO4。
配制0.01 mol·L-1 KMnO4溶液时若仰视定容,使c(KMnO4)减小,则在进行滴定操作时消耗V (KMnO4)会变大,导致Na2SO3含量偏大。
分析滴定数据,第三组数据明显偏小,滴定中误差很大,计算时应舍去。
[考点]化学实验


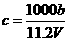 B.
B.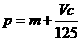 C.n=m+17Vc D.
C.n=m+17Vc D.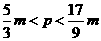

 2Al(OH)3↓+3H2↑+3Cl2↑。根据电解的总反应式和质量守恒可知选项A正确。根据得失电子守恒可知选项D也正确。
2Al(OH)3↓+3H2↑+3Cl2↑。根据电解的总反应式和质量守恒可知选项A正确。根据得失电子守恒可知选项D也正确。


