(二)选考题:
36.[化学--选修化学与技术](15分)
硫酸工业生产应考虑综合经济效益问题。
(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在 的郊区(填选项的标号)
A.有丰富黄铁矿资源的城市 B.风光秀丽的旅游城市
C.消耗硫酸甚多的工业城市 D.人口稠密的文化、商业中心城市
(2)据测算,接触法制硫酸过程中,若反应热都未被利用,则每生产1t 98%硫酸需消耗3.6×105kJ能量。请通过计算判断,若反应:SO2(g)+1/2O2(g)=SO3(g);△H=-98.3kJ·mol-1;放出的热量能在生产过程中得到充分利用,则每生产1t98%硫酸只需外界提供(或可向外界输出) 千焦能量;
(3)CuFeS2是黄铁矿的另一成分,煅烧时,CuFeS2转化为CuO、Fe2O3和SO2,该反应的化学方程式为 。
(4)由硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3在沸腾炉中化合而成),其中硫酸铜的质量分数随沸腾炉温度不同而变化(见下表)
|
沸腾炉温度/℃ |
600 |
620 |
640 |
660 |
|
矿渣中CuSO4的质量分数/% |
9.3 |
9.2 |
9.0 |
8.4 |
已知CuSO4在低于660℃时不会分解,请简要分析上表中CuSO4的质量分数随温度升高而降低的原因 。
37.[化学--选修物质结构与性质](15分)
乙炔是有机合成工业的一种原料。工业上曾用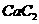 与水反应生成乙炔。
与水反应生成乙炔。
(1)将乙炔通入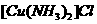 溶液生成
溶液生成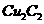 红棕色沉淀。
红棕色沉淀。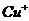 基态核外电子排布式为
。
基态核外电子排布式为
。
(2) Ca2+的原子结构示意图:
;已知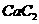 中
中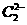 与
与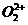 互为等电子体,
互为等电子体,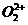 的电子式可表示为 ;1mol
的电子式可表示为 ;1mol 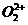 中含有的
中含有的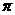 键数目为
。
键数目为
。
(3)乙炔与氢氰酸反应可得丙烯腈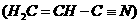 。丙烯腈分子中碳原子轨道杂化类型是
;分子中处于同一直线上的原子数目最多为
。
。丙烯腈分子中碳原子轨道杂化类型是
;分子中处于同一直线上的原子数目最多为
。
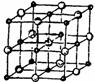 (4)
(4)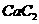 晶体的晶胞结构与
晶体的晶胞结构与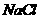 晶体的相似(如下图所示),但
晶体的相似(如下图所示),但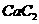 晶体中含有的哑铃形
晶体中含有的哑铃形 的存在,使晶胞沿一个方向拉长。
的存在,使晶胞沿一个方向拉长。 晶体中1个
晶体中1个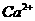 周围距离最近的
周围距离最近的 数目为
。
数目为
。
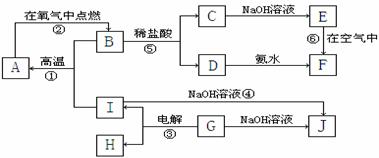
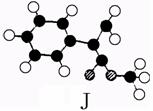
38.[化学--选修有机化学](15分)
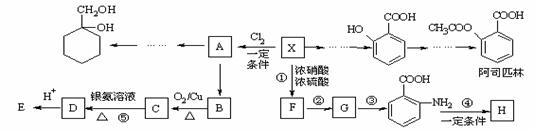 相对分子质量为92的某芳香烃X是一种重要的有机化工原料,研究部门以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。其中A是一氯代物,H是一种功能高分子,链节组成为C7H5NO。
相对分子质量为92的某芳香烃X是一种重要的有机化工原料,研究部门以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。其中A是一氯代物,H是一种功能高分子,链节组成为C7H5NO。
已知:
Ⅰ  Ⅱ
Ⅱ 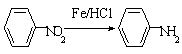

(苯胺,易被氧化)
请根据所学知识与本题所给信息回答下列问题:
⑴ H的结构简式是 ;
⑵反应②、③的类型分别是 , 。
⑶ 反应⑤的化学方程式是______________________________ ______;
⑷ 阿司匹林最多消耗 mol NaOH;
⑸ 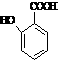 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有 种;ks*5*u
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有 种;ks*5*u
⑹ 请用合成反应流程图表示出由A和其他无机物合成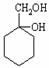 最合理的方案(不超过4步)。
最合理的方案(不超过4步)。
 例:
例:
7.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. 时,pH = 13的1L Ba(OH)2溶液中含有OH-数目为0.1NA
时,pH = 13的1L Ba(OH)2溶液中含有OH-数目为0.1NA
B.200mL 5mol·L-1Na2S溶液中,含NA个S2-
C.常温下,pH=12的1L氨水中含有的NH3·H2O分子数是0.01 NA
D.电解精炼铜时,若阴极得到电子数为2NA个,则阳极质量减少64g
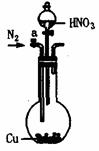
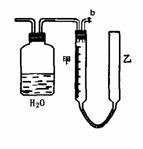
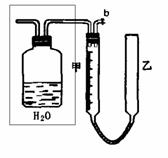
8.下列实验装置设计正确且能达到目的的是( )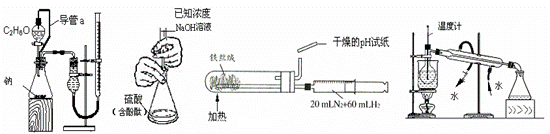
测定乙醇结构式 滴定法测定硫酸 合成氨并检验氨的生成 碘的CCl4溶液中分离I2
的物质的量的浓度 并回收CCl4
A B C D
9.下列离子方程式错误的是( )
A.氯气通入水中:C12 + H2O  H+ + C1-+ HClO
H+ + C1-+ HClO
B.向3%的双氧水中通入少量SO2:H2O2 + SO2 === 2H+ + SO42-
C.碳酸钠水解:CO32- + 2H2O  H2CO3 + 2OH-
H2CO3 + 2OH-
D.向NaHCO3溶液中加入过量石灰水:Ca2+ + OH-+ HCO3-=== CaCO3↓+ H2O
10.下列现象或反应的原理解释正确的是( )
|
选项 |
现象或反应 |
原理解释 |
|
A |
铝箔在酒精灯火焰上加热熔化但不滴落 |
铝箔对熔化的铝有较强的吸附作用 |
|
B |
合成氨反应需在高温条件下进行 |
该反应为吸热反应 |
|
C |
镀层破损后,镀锡铁比镀锌铁易腐蚀 |
锡比锌活泼 |
|
D |
2CO = 2C
+ O2在任何条件下均不能自发进行 |
该反应△H > 0,△S < 0 |
11.某溶液中只可能含有下列离子中的几种(不考虑溶液中含的较少的H+和OH-)Na+、NH4+、SO42-、CO32-、NO3-。取200mL该溶液,分为等体积的两份分别做下列实验。实验1:第一份加入足量的烧碱并加热,产生的气体在标准状况下为224mL。实验2:第二份先加入足量的盐酸,无现象,再加足量的BaCl2溶液,得固体2.33g。下列说法正确的是( )
A.该溶液中可能含有Na+ B.该溶液中肯定含有NH4+、S042-、CO32-、NO3-
C.该溶液中一定不含NO3- D.该溶液中一定含Na+,且c(Na+)≥0.1 mol/L
12.铜和镁的合金2.14g完全溶于一定浓度的硝酸,若反应中硝酸被还原为NO2、NO、N2O 三种气体且标准状况下体积均为0.224L,在反应后的溶液中,加入足量的氢氧化钠溶液,生成的沉淀经过滤、洗涤、干燥后称量,质量为( )
A.3.12 g B. 4.18 g C.4.68 g D.5.08 g
13.A、B、C为三种短周期元素,A、B同周期,A、C的最低价离子分别为A2-、C-,
B2+与C-具有相同的电子层结构,下列叙述一定不正确的是( )
A.离子半径A2- > C- > B2+ B.它们的原子序数A > B > C
C.它们的原子半径C > B > A D.原子最外层上的电子数C > A > B
第Ⅱ卷(必考题129分,选考题45分,共174分)
本卷包括秘考题和选考题两部分。第22-32题为必考题,每个试题考生都做答;第33题-41题为选考题,考生根据要求作答。
28.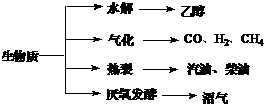 (15分)生物质资源是一种污染小的可再生能源。生物质的主要转化途径及主要产物如下图。
(15分)生物质资源是一种污染小的可再生能源。生物质的主要转化途径及主要产物如下图。
(1)下列有关说法正确的是 。
a.生物质能,本质上能量来源于太阳能
b.由纤维素水解获得的乙醇作燃料是利用了生物质能
c.生物质裂解获得的汽油、柴油等属于纯净物 www.k@s@5@ 高#考#资#源#网
d.由植物秸杆等厌氧发酵获得的沼气,主要成分是甲烷
(2)由生物质能获得的CO和H2,可以合成甲醇和二甲醚(CH3OCH3)及许多烃类物质。当两者1∶1催化反应,其原子利用率达100%,合成的物质可能是 。
a.汽油 b.甲醇 c.甲醛 d.乙酸
(3)甲醇是一种重要的化工原料,工业上合成甲醇的反应:
CO(g)+2H2(g) CH3OH(g)
;△H= -90.8kJ·mol-1。
CH3OH(g)
;△H= -90.8kJ·mol-1。
若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
|
容器 |
甲 |
乙 |
丙 |
|
反应物投入量 |
1molCO 、2molH2 |
1mol CH3OH |
2molCO、4molH2 |
|
CH3OH的浓度(mol/L) |
c1 |
c2 |
c3 |
|
反应的能量变化 |
放出Q1
kJ |
吸收Q2
kJ |
放出Q3
kJ |
|
反应物转化率 |
α 1 |
α 2 |
α 3 |
下列说法正确的是 。
a. c1 = c2 b. 2Q1 = Q3 c. α2+ α3< 100%
(4)在一定温度和压强下,CO和H2催化合成二甲醚的反应为:
3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)
CH3OCH3(g)+CO2(g)
 ①若一体积可变的密闭容器中充入3 mol H2、3 mol CO、1 mol CH3OCH3、1 mol CO2,经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。则:①反应开始时正、逆反应速率的大小:v(正)____v(逆)(填“ >”、“ < ”或“=”),理由是
①若一体积可变的密闭容器中充入3 mol H2、3 mol CO、1 mol CH3OCH3、1 mol CO2,经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。则:①反应开始时正、逆反应速率的大小:v(正)____v(逆)(填“ >”、“ < ”或“=”),理由是
。
平衡时n(CH3OCH3)= mol。
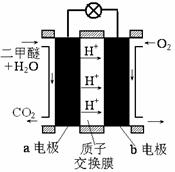
②右图为绿色电源“直接二甲醚燃料电池”的工作原理示意图。
b电极是 极;
a电极的反应式为 。
27.(15分)某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1mol/L。
|
阳离子 |
K+ Cu2+ Fe3+ Al3+ Fe2+ |
|
阴离子 |
Cl- CO32- NO3- SO42- SiO32- |
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
Ⅱ.取少量溶液,加入KSCN溶液无明显变化。
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
Ⅳ. 向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是 (写离子符号)。
(2)Ⅲ中加入少量盐酸生成无色气体的的离子方程式是_________________________。
(3)将Ⅲ中所得红棕色气体通入水中,气体变无色,所发生的化学方程式为
_______________________________________________________________
(4)甲同学最终确定原溶液中所含阳离子是 ,阴离子是 。(写离子符号)
(5)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为 g。
(6)工业废水中常含有不同类型的污染物,可采用不同的方法处理。以下是乙同学针对含不同污染物的废水提出的处理措施和方法,其中正确的是( )
|
选项 |
污染物 |
处理措施 |
方法类别 |
|
A |
废酸 |
加生石灰中和 |
物理法 |
|
B |
Cu2+等重金属离子 |
加硫酸盐沉降 |
化学法 |
|
C |
含复杂有机物的废水 |
通过微生物代谢 |
物理法 |
|
D |
碱性的废水 |
用CO2来中和 |
化学法 |
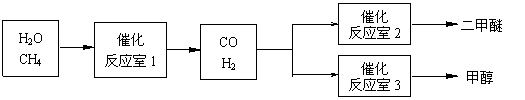
 CO(g)+3H2(g) △H>0。
CO(g)+3H2(g) △H>0。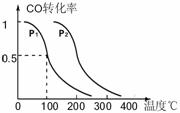 (3)在压强为0.1MPa条件下,反应室3(容积为VL)中amolCO与2amolH2在催化剂作用下反应生成甲醇:CO(g) +2H2(g)
(3)在压强为0.1MPa条件下,反应室3(容积为VL)中amolCO与2amolH2在催化剂作用下反应生成甲醇:CO(g) +2H2(g)  CH3OH(g),CO的平衡转化率与温度、压强的关系如右图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如右图所示,则: CO(g) + 2H2(g)反应的平衡常数为
CO(g) + 2H2(g)反应的平衡常数为 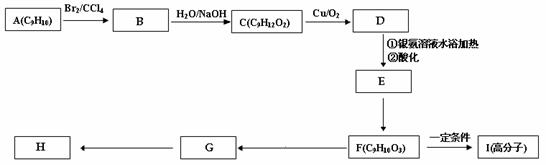
 C2H5NH2·H2O+H3O+
C2H5NH2·H2O+H3O+