38、
肉桂醛在食品、医药化工等方面都有重要应用。
(1)下列是合成肉桂醛、制备肉桂酸的反应路线:
|
|
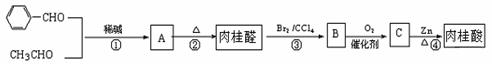
实验表明:
Ⅰ. A既能发生银镜反应,又能与金属钠反应放出氢气;
Ⅱ. 肉桂醛的相对分子质量不超过140,其中碳氢元素质量分数为87.89%。
Ⅲ. 核磁共振氢谱表明肉桂醛分子中有六种氢,其峰面积之比为1:1:1:2:2:1;
(1)A中含有的官能团为
(2) 请写出肉桂醛的结构简式。
----------------------------
(3) 已知反应①的原子利用率为100%,请写出第①步的化学反应方程式。
(4)反应(1)的反应类型 反应(2)的反应类型为
(5) 请写出上述合成路线中使用③④两步反应的目的。
(6)写出反应⑤的化学方程式 。
(7) 请写出与肉桂醛互为同分异构体,且同时满足 a.分子中无甲基,b.所有碳原子一定在同一平面上c、苯环上一氯代物只有两种的有机物的结构简式。
27.(13分)
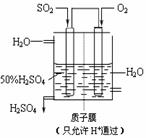
 氧化铜有多种用途,如用作玻璃着色剂、油类脱硫剂等。为获得纯净的氧化铜,某同学用工业硫酸铜(含硫酸亚铁等杂质)进行如下实验:
氧化铜有多种用途,如用作玻璃着色剂、油类脱硫剂等。为获得纯净的氧化铜,某同学用工业硫酸铜(含硫酸亚铁等杂质)进行如下实验:
经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下:
|
物质 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
|
开始沉淀pH |
6.0 |
7.5 |
1.4 |
|
沉淀完全pH |
13 |
14 |
3.7 |
⑴ 步骤Ⅰ的目的是除不溶性杂质。所需操作的名称是____________。
⑵ 步骤Ⅱ的目的是除硫酸亚铁。操作步骤是先滴加H2O2溶液,稍加热,当Fe2+转化完全后,慢慢加入Cu2(OH)2CO3粉末,搅拌,以调整溶液pH在一定范围之内,加热煮沸一段时间,过滤,用稀硫酸酸化滤液至pH=1。
①写出用H2O2溶液除去硫酸亚铁的离子方程式________________________。
②调整pH 的范围应该在____________之间。
⑶ 步骤Ⅲ的目的是得到CuSO4·5H2O晶体。操作是将溶液加热蒸发至有晶膜出现时,停止加热,____________,水浴加热烘干。采用水浴加热的原因是______。
⑷ 该同学用CuSO4溶液进行如下探究实验:
取A、B两支试管,分别加入 2 mL 5% H2O2溶液,再向H2O2溶液中分别滴入 0.1 mol·L-1 FeCl3和CuSO4 溶液各1 mL,摇匀,观察到滴入FeCl3 溶液的试管产生气泡更快,由此得到结论:Fe3+对H2O2溶液分解的催化效率比Cu2+高,该同学的结论是否正确___________(填正确或错误),请说明原因___________。
25.(15分)铁元素及其化合物与人类的生产生活息息相关,回答下列问题
⑴ 铁酸钠(Na2FeO4)是一种新型水处理剂,它有比高锰酸钾更强的氧化性,在水中反应被还原为Fe3+。
①铁酸钠中铁元素的化合价为_____。
②铁酸钠用于水处理,除了能消毒杀菌外,还可以像明矾(KAl(SO4)2)一样起到净水作用,请说明明矾的净水原理:______。(用离子方程式表示)
 ⑵ 反应ⅠFe(s)+CO2(g)
FeO(s)+CO(g) △H=a kJ・mol-1,平衡常数为K;
⑵ 反应ⅠFe(s)+CO2(g)
FeO(s)+CO(g) △H=a kJ・mol-1,平衡常数为K;
反应ⅡCO(g)+1/2O2(g)=CO2(g) △H=b kJ・mol-1
测得在不同温度下,K值如下:
|
温度/℃ |
500 |
700 |
900 |
|
K |
1.00 |
1.47 |
2.40 |
①写出K的表达式__________________。
②反应Ⅰ中的a____________0(填大于、小于、等于)。
③若500℃时进行反应Ⅰ,CO2起始浓度为2mol・L-1,CO的平衡浓度为____________mol・L-1。
④700℃反应Ⅰ达到平衡,要使得该平衡向右移动,其它条件不变时,可以采取的措施有____________(填序号)。
A.缩小反应器体积 B.通入CO2
C.升高温度到900℃ D.使用合适的催化剂
⑤由反应Ⅰ和Ⅱ可求得,反应2Fe(s)+O2(g)=2FeO(s)的△H=______kJ・mol-1。
⑶ 铁红是一种红色颜料,其成份是Fe2O3。将一定量的铁红溶于160 mL 5 mol·L-1盐酸中,再加入一定量铁粉恰好完全溶解,收集到气体2.24 L(标准状况),经检测,溶液中无Fe3+,则参加反应的铁粉的质量为______g。
 比
比 少一个电子层,B原子得一个电子后3p轨道全满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于中子数。R是由A、D两元素形成的离子化合物,其中A与D离子数之比为2:1。请回答下列问题:
少一个电子层,B原子得一个电子后3p轨道全满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于中子数。R是由A、D两元素形成的离子化合物,其中A与D离子数之比为2:1。请回答下列问题: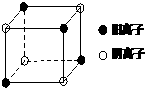 (3)写出D原子的核外电子排布式
_,C的氢化物比D的氢化物在水中溶解度大得多的可能原因
。
(3)写出D原子的核外电子排布式
_,C的氢化物比D的氢化物在水中溶解度大得多的可能原因
。 其化学式是
其化学式是
 +
+ 青 2
青 2 ;
; H=180.74KJ/mol.此反应称为伯克莱特-艾,
H=180.74KJ/mol.此反应称为伯克莱特-艾, V,从一块云移到另一块云的电荷量为30000C,此次闪电释放出的能量为 KJ .
V,从一块云移到另一块云的电荷量为30000C,此次闪电释放出的能量为 KJ .
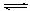 SO3(g);△H= -98 kJ· mol-1。开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0molO2(g),当反应达到平衡时混合气体的总物质的量为8.0mol,该温度下平衡常数K=
。
SO3(g);△H= -98 kJ· mol-1。开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0molO2(g),当反应达到平衡时混合气体的总物质的量为8.0mol,该温度下平衡常数K=
。 A、保持温度和容器压强不变,充入2mol SO3
A、保持温度和容器压强不变,充入2mol SO3 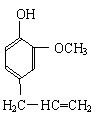 ⑴ A的分子式是______________。
⑴ A的分子式是______________。 ⑷ 已知:
⑷ 已知: