11.下列是治疗口腔炎症的药物华素片(西地碘片)的部分使用说明:
|
使用说明书 |
|
|
主要成分 |
活性分子碘含量:1.5 mg/片 |
|
贮藏 |
遮光、密闭、在阴凉处保存 |
|
有效期 |
二年 |
请根据上述说明回答:
(1)推断华素片________(填“是”或“不是”)白色。
(2)某同学欲证实该药片中确定含有分子碘,设计并完成如下实验:①将药片研碎、溶解、过滤,所得滤液分装于甲、乙两试管中备用。
②在甲试管中加入下列一种试剂,振荡、静置,观察到液体分层,上层液体颜色为________色,所加试剂为下列中的______________,由此说明分子碘的存在。
A.苯 B.酒精
C.四氯化碳 D.盐酸
③在乙试管中滴加________溶液,溶液变蓝色,也说明了分子碘的存在。
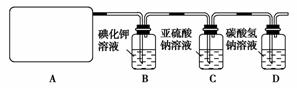
(3)碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间有如下转化关系:
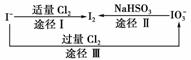
①如以海水为原料制取I2,加的Cl2要适量,如过量就会发生途径Ⅲ的副反应。在该反应产物中,IO3-与Cl-物质的量之比为1∶6,则氧化剂和还原剂物质的量之比为__________。
②如以途径Ⅱ在溶液中制取I2,反应后的溶液显酸性,则反应离子方程式是______________________________________。
[解析] (1)碘单质是紫黑色固体。(2)I2难溶于水,易溶于苯或四氯化碳,苯的密度比水小,四氯化碳的密度比水大。(3)①3Cl2+I-+3H2O===6Cl-+IO3-+6H+;②注意HSO3-不可拆分。
[答案] (1)不是 (2)②紫红(或浅紫) A(或C) ③淀粉
(3)①3∶1 ②2IO3-+5HSO3-===5SO42-+H2O+3H++I2