10.(2010·河南省调研)在200 mL 1mol·L-1的NaHCO3溶液中,加入一定量的单质或化合物X,恰好使其转化为只含Na2CO3溶质的溶液,实现转变的物质X有多种,符合条件的一组是( )
|
选项 |
A |
B |
C |
D |
|
X的化学式 |
Na |
Na2O |
Na2O2 |
NaOH |
|
加入X的质量(g) |
4.8 |
6.4 |
7.8 |
16.0 |
解析:本题考查了元素及其化合物的有关计算。NaOH+NaHCO3===Na2CO3+H2O,则恰好使NaHCO3溶液转化为只含Na2CO3溶质的溶液,需要NaOH 0.2 mol,A、B与水反应生成的NaOH均大于0.2 mol,D中NaOH为0.4 mol,C中7.8 g Na2O2与水反应恰好生成0.2 mol NaOH。
答案:C
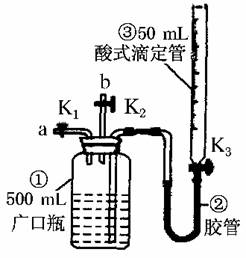
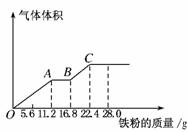
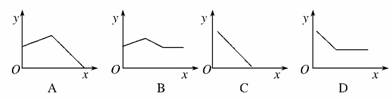
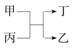 甲丙丁乙,则甲和乙可以是( )
甲丙丁乙,则甲和乙可以是( )