摘要:9.已知X.Y和Z三种元素的原子序数之和等于42.X元素原子的4p轨道上有3个未成对电子.Y元素原子的最外层2p轨道上有2个未成对电子.X跟Y可形成化合物X2Y3.Z元素可以形成负一价离子.请回答下列问题: (1)X元素原子基态时的电子排布式为 .该元素的符号是 , (2)Y元素原子的价层电子的轨道表示式为 .该元素的名称是 , (3)X与Z可形成化合物XZ3.该化合物的空间构型为 , (4)比较X的氢化物与同族第二.三周期元素所形成的氢化物稳定性.沸点高低并说明理由 . [解析] (1)因为X原子4p轨道上有3个未成对电子.可知其电子排布式为:1s22s22p63s23p63d104s24p3并推出其元素符号为As. (2)根据Y元素的最外层2p轨道上有2个未成对电子.Y和Z元素的原子序数之和为42-33=9.Y可能为1s22s22p2或1s22s22p4.再根据Z可形成负一价离子.推出Y电子排布为后者.电子排布图为 ↑↓ 2s ↑↓ ↑ ↑ 2p .元素名称为氧.Z为氢. (3)X与Z形成的化合物为AsH3.其空间构型可类比同主族的氢化物NH3.为三角锥形. (4)氢化物的稳定性和元素的非金属性有关.或与共价键的键长有关.键长越短.键能越大.氢化物越稳定.所以NH3>PH3>AsH3. [答案] (1)1s22s22p63s23p63d104s24p3 As (2) ↑↓ 2s ↑↓ ↑ ↑ 2p 或 ↑↓ 2s ↑↓ ↑ ↑ 2p 氧 (3)三角锥形 (4)稳定性:NH3>PH3>AsH3.因为键长越短.键能越大.化合物越稳定. 沸点:NH3>AsH3>PH3.NH3可以形成分子间氢键.沸点最高,AsH3相对分子质量比PH3大.分子间作用力大.因而AsH3的沸点比PH3高
网址:http://m.1010jiajiao.com/timu3_id_86571[举报]
已知X、Y和Z三种元素的原子序数之和等于42.X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子.X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子.请回答下列问题:
(1)X元素的符号是
(2)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是
(3)比较X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性高低
查看习题详情和答案>>
(1)X元素的符号是
As
As
该原子基态时的电子排布式为1s22s22p63s23p63d104s24p3
1s22s22p63s23p63d104s24p3
.(2)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是
As2O3+6Zn+6H2SO4═2AsH3↑+6ZnSO4+3H2O
As2O3+6Zn+6H2SO4═2AsH3↑+6ZnSO4+3H2O
_.(3)比较X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性高低
NH3>PH3>AsH3
NH3>PH3>AsH3
,理由是键长N-H<P-H<As-H,键长越短,键能越大,化合物稳定
键长N-H<P-H<As-H,键长越短,键能越大,化合物稳定
. 【化学--选修3:物质结构与性质】
【化学--选修3:物质结构与性质】已知X、Y和Z三种元素的原子序数之和等于48.X的一种1:2型氢化物分子中既有σ键又有π键,所有原子共平面.Z是金属元素,Z的单质和化合物有广泛的用途.已知Z的核电荷数小于28,且次外层有2个未成对电子.工业上利用ZO2和碳酸钡在熔融状态下制化合物M(M可看做一种含氧酸盐).经X射线分析,M晶体的最小重复单元为正方体(如图),顶点位置为Z4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占.
(1)Y2+的结构示意图


3d24s2
3d24s2
.(2)X在该氢化物中以
sp2
sp2
方式杂化;X和Y形成的化合物YX2的电子式为

(3)①制备M的化学反应方程式是
TiO2+BaCO3
BaTiO3+CO2↑
| ||
TiO2+BaCO3
BaTiO3+CO2↑
;
| ||
②在M晶体中,若将Z4+置于立方体的体心,Ba2+置于立方体的顶点,则O2-处于立方体的
面心
面心
;③已知O2-半径为1.4×10-10 m,Z4+的半径为6.15×10-11m,阿佛加德罗常数为NA,则M的密度为
| 233g/mol |
| (4.03×10-8 cm)3NA |
| 233g/mol |
| (4.03×10-8 cm)3NA |
已知X、Y和Z三种元素的原子序数之和等于42.X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子.X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子.室温下元素W的单质是淡黄色粉末状固体,在空气中燃烧生成的气体是形成酸雨的主要污染物之一.元素R的单质在常温常压下是黄绿色气体,能溶于水.请回答下列问题:
(1)X元素原子基态时的电子排布式为
(2)Y元素原子的价电子的轨道表示式为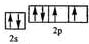
 ,该元素的名称是
,该元素的名称是
(3)X与Z可形成化合物XZ3,该化合物的空间构型为
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是
(5)W、R 两元素非金属性较强的是
查看习题详情和答案>>
(1)X元素原子基态时的电子排布式为
1s22s22p63s23p63d104s24p3
1s22s22p63s23p63d104s24p3
,该元素的符号是As
As
;(2)Y元素原子的价电子的轨道表示式为


氧
氧
;(3)X与Z可形成化合物XZ3,该化合物的空间构型为
三角锥
三角锥
;(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是
As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O
As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O
;(5)W、R 两元素非金属性较强的是
Cl
Cl
(写元素符号).写出能够证明这一结论的一个实验事实高氯酸的酸性强于硫酸或氯化氢的稳定性强于硫化氢
高氯酸的酸性强于硫酸或氯化氢的稳定性强于硫化氢
.已知X、Y和Z三种元素的原子序数之和等于42.X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子.X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子.
请回答下列问题:
(1)X元素原子基态时的电子排布式为
(2)Y元素原子的价层电子的轨道表示式为
 ,该元素的名称是
,该元素的名称是
(3)X与Z可形成化合物XZ3,该化合物的空间构型为
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是
(5)比较X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性高低
查看习题详情和答案>>
请回答下列问题:
(1)X元素原子基态时的电子排布式为
1s22s22p63s23p63d104s24p3
1s22s22p63s23p63d104s24p3
,该元素的符号是As
As
.(2)Y元素原子的价层电子的轨道表示式为


氧
氧
.(3)X与Z可形成化合物XZ3,该化合物的空间构型为
三角锥
三角锥
.(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是
三角锥
三角锥
.(5)比较X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性高低
稳定性:NH3>PH3>AsH3
稳定性:NH3>PH3>AsH3
,理由是因为键长越短,键能越大,化合物越稳定
因为键长越短,键能越大,化合物越稳定
.【化学选修3物质结构与性质】已知X、Y和Z三种元素的原子序数之和等于42.X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子.X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子.请回答下列问题:
(1)X元素原子基态时的电子排布式为 ,该元素的符号是 .
(2)Y元素原子的电子轨道表示式为 ,元素X与Y的电负性比较:X Y(填“>”或“<”).
(3)X与Z可形成化合物XZ3,该化合物的空间构型为 .
(4)由元素X与镓元素组成的化合物A为第三代半导体.
已知化合物A的晶胞结构如图所示.(黑球位于立方体内,白球位于立方体顶点和面心)

请写出化合物A的化学式 :化合物A可由(CH3)3Ga和AsH3在700℃下反应制得,反应的化学方程式为
(5)已知(CH3)3Ga为非极性分子,则其中镓原子的杂化方式为 .
查看习题详情和答案>>
(1)X元素原子基态时的电子排布式为
(2)Y元素原子的电子轨道表示式为
(3)X与Z可形成化合物XZ3,该化合物的空间构型为
(4)由元素X与镓元素组成的化合物A为第三代半导体.
已知化合物A的晶胞结构如图所示.(黑球位于立方体内,白球位于立方体顶点和面心)

请写出化合物A的化学式
(5)已知(CH3)3Ga为非极性分子,则其中镓原子的杂化方式为