摘要:13.现有含NaCl.Na2SO4.NaNO3的混合溶液.选择适当的试剂将其转化为相应的沉淀或固体.从而实现Cl-.SO.NO的相互分离.相应的实验过程可用下图表示: (1)写出上述实验过程中所用试剂的名称: 试剂1 . 试剂2 . (2)恰当地控制试剂4的加入量的方法是 . (3)加入过量试剂3的目的是 . (4)操作①的名称是 .在加入试剂4后.获得固体D的实验操作④是 . (5)写出加入试剂4后发生反应的离子方程式 . (6)要检验原混合溶液中的Cl-.应该如何操作 . 解析:这是一道物质的分离题.解题的关键是确定所加的试剂及加入试剂的顺序.沉淀Cl-应加入AgNO3.沉淀SO应加入BaCl2或Ba(NO3)2溶液.因为SO也能和Ag+反应.所以要在沉淀SO后加入AgNO3.为了除去过量的Ag+和Ba2+.应加入过量的Na2CO3溶液.最后加入硝酸.调节溶液的pH=7. 答案:(1)氯化钡溶液或硝酸钡溶液 硝酸银溶液 (2)测定溶液的pH (3)除去溶液中过量的Ba2+.Ag+ (4)过滤 蒸发.冷却结晶.过滤 (5)CO+2H+===CO2↑+H2O (6)取原溶液少量于试管中.先加入足量Ba(NO3)2溶液沉淀SO.过滤后向滤液中加AgNO3溶液检验Cl-
网址:http://m.1010jiajiao.com/timu3_id_85119[举报]
现有含NaCl、Na2SO4、NaNO3的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、NO3-的相互分离.相应的实验过程可用下列流程图表示: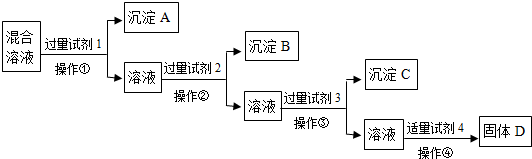
(1)写出上述实验过程中所用试剂的名称:
试剂1
(2)恰当地控制试剂4的加入量的方法是
(3)加入过量试剂3的目的是
(4)在加入试剂4后,获得固体D的实验操作④是
查看习题详情和答案>>

(1)写出上述实验过程中所用试剂的名称:
试剂1
BaCl2[或Ba(NO3)2]
BaCl2[或Ba(NO3)2]
试剂2AgNO3
AgNO3
试剂4稀HNO3
稀HNO3
(2)恰当地控制试剂4的加入量的方法是
测定溶液pH
测定溶液pH
(3)加入过量试剂3的目的是
除去溶液中过量的Ag+、Ba2+
除去溶液中过量的Ag+、Ba2+
(4)在加入试剂4后,获得固体D的实验操作④是
蒸发、冷却、结晶、过滤
蒸发、冷却、结晶、过滤
(填操作名称).现有含NaCl、Na2SO4、NaNO3的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SOO42-、NOO3-的相互分离.相应的实验过程可用如图表示:
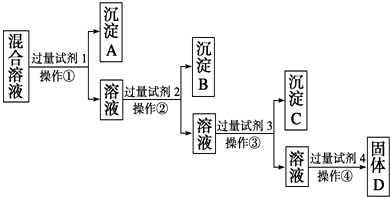
(1)写出上述实验过程中所用试剂的名称:试剂1为
(2)控制试剂4的加入量的方法是
(3)加入过量试剂3的目的是
(4)操作①的名称是
(5)写出加入试剂4后发生反应的化学方程式:
查看习题详情和答案>>

(1)写出上述实验过程中所用试剂的名称:试剂1为
氯化钡溶液(或硝酸钡溶液)
氯化钡溶液(或硝酸钡溶液)
,试剂2为硝酸银溶液
硝酸银溶液
.(2)控制试剂4的加入量的方法是
测定溶液的pH
测定溶液的pH
.(3)加入过量试剂3的目的是
除去溶液中过量的Ba2+、Ag+
除去溶液中过量的Ba2+、Ag+
.(4)操作①的名称是
过滤
过滤
,在加入试剂4后,获得固体D的实验操作④是加热蒸发、冷却结晶、过滤
加热蒸发、冷却结晶、过滤
(填操作名称).(5)写出加入试剂4后发生反应的化学方程式:
Na2CO3+2HNO3═2NaNO3+CO2↑+H2O
Na2CO3+2HNO3═2NaNO3+CO2↑+H2O
.现有含NaCl、Na2SO4、NaNO3的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、NO3-的相互分离.相应的实验过程可用下列流程图表示: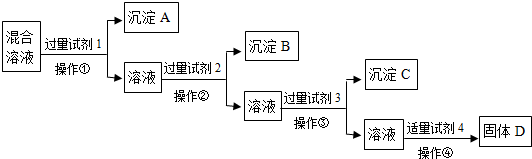
(1)写出上述实验过程中所用试剂的名称:
试剂1______ 试剂2______ 试剂4______
(2)恰当地控制试剂4的加入量的方法是______
(3)加入过量试剂3的目的是______
(4)在加入试剂4后,获得固体D的实验操作④是______(填操作名称).
查看习题详情和答案>>
现有含NaCl、Na2SO4、NaNO3的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO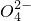 、NO
、NO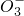 的相互分离.相应的实验过程可用如图表示:
的相互分离.相应的实验过程可用如图表示:
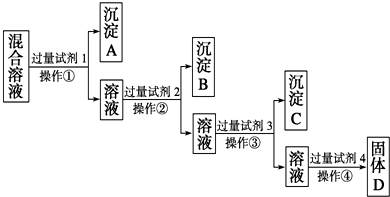
(1)写出上述实验过程中所用试剂的名称:试剂1为______,试剂2为______.
(2)控制试剂4的加入量的方法是______.
(3)加入过量试剂3的目的是______.
(4)操作①的名称是______,在加入试剂4后,获得固体D的实验操作④是______(填操作名称).
(5)写出加入试剂4后发生反应的化学方程式:______.
查看习题详情和答案>>
现有含NaCl、Na2SO4、NaNO3的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、NO3-的相互分离.相应的实验过程可用下图表示
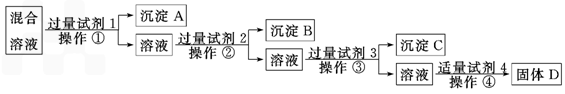
(1)写出上述实验过程中所用试剂的名称:试剂1_______________,试剂2_____________.
(2)恰当地控制试剂4的加入量的方法是____________________.
(3)加入过量试剂3的目的是_____________________________________.
(4)操作①的名称是________,在加入试剂4后,获得固体D的实验操作④是____________________________(填操作名称).
(5)写出加入试剂4后发生反应的离子方程式_________________________.
(6)要检验原混合溶液中的Cl-,应该如何操作_________________________________.
查看习题详情和答案>>
(2)恰当地控制试剂4的加入量的方法是____________________.
(3)加入过量试剂3的目的是_____________________________________.
(4)操作①的名称是________,在加入试剂4后,获得固体D的实验操作④是____________________________(填操作名称).
(5)写出加入试剂4后发生反应的离子方程式_________________________.
(6)要检验原混合溶液中的Cl-,应该如何操作_________________________________.