13.某同学用下图所示做水果电池的实验,测得数据如下表所示:

|
实验编号 |
电极材料 |
水果品种 |
电极间距/cm |
电压/mV |
|
|
1 |
锌 |
铜 |
菠萝 |
3 |
900 |
|
2 |
锌 |
铜 |
苹果 |
3 |
650 |
|
3 |
锌 |
铜 |
柑橘 |
3 |
850 |
|
4 |
锌 |
铜 |
西红柿 |
3 |
750 |
|
5 |
锌 |
铝 |
菠萝 |
3 |
650 |
|
6 |
锌 |
铝 |
苹果 |
3 |
450 |
请回答以下问题:
(1)实验6中负极的电极反应式为________.
(2)实验1、5中电流方向相反的原因是________.
(3)影响水果电池的电压的因素有________、________.
(4)若在实验中发光二极管不亮,该同学用铜、锌作电极,用菠萝作介质,并将多个此电池串联起来,再按发光二极管,这样做________.(填“合理”或“不合理”)
解析:(1)实验6中电极是Zn与Al,因Al更活泼,故负极反应为Al-3e-===Al3+.
(2)因实验1中锌比铜活泼,锌为负极;实验5中铝比锌活泼,锌为正极,故两实验中电流方向相反.
(3)由实验1和5可知,水果电池的电压与水果的品种及电极材料有关.
(4)这样做可使电压增大,合理.
答案:(1)Al-3e-===Al3+
(2)实验1中锌比铜活泼,锌为负极;实验5中锌比铝活泼性差,锌为正极,所以两实验中电流方向相反
(3)水果品种 电极材料 (4)合理



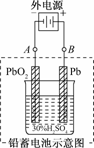 Pb+PbO2+4H++2SO
Pb+PbO2+4H++2SO 2PbSO4+2H2O
2PbSO4+2H2O