网址:http://m.1010jiajiao.com/timu3_id_84444[举报]
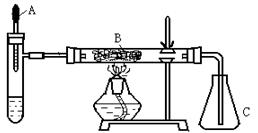
 已知多种重金属化合物能催化H2O2的分解.试管中加入过量浓氨水并滴入2ml 5%AgNO3溶液;A为胶头滴管,预先吸有25%的H2O2溶液; B中装有铂石棉催化剂.点燃酒精灯一段时间后,将A中的H2O2溶液慢慢地滴入试管,试管内产生大量气体.不久,锥形瓶C内出现明显的颜色变化.回答下列问题:
已知多种重金属化合物能催化H2O2的分解.试管中加入过量浓氨水并滴入2ml 5%AgNO3溶液;A为胶头滴管,预先吸有25%的H2O2溶液; B中装有铂石棉催化剂.点燃酒精灯一段时间后,将A中的H2O2溶液慢慢地滴入试管,试管内产生大量气体.不久,锥形瓶C内出现明显的颜色变化.回答下列问题:(1)你认为反应中能催化分解H2O2的物质是(写化学式)
(2)试管中产生的气体是
(3)B中发生反应的化学方程式
(4)本实验还可以改用其他药品,例如在试管中加固体
(5)除干燥装置外,此实验装置的缺点是还缺少
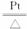
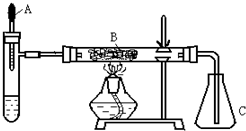
(1)你认为反应中能催化分解H2O2的物质是(写化学式)_____________。
(2)试管中产生的气体是_____________。
(3)B中发生反应的化学方程式为___________________________________________。
(4)本实验还可以改用其他药品,例如在试管中加固体___________,胶头滴管预先吸入液体___________。
(5)除干燥装置外,此实验装置的缺点是还缺少___________装置。
查看习题详情和答案>>(10分)已知多种重金属化合物能催化H2O2的分解。试管中加入过量浓氨水并滴入2ml 5%AgNO3溶液;A为胶头滴管,预先吸有25%的H2O2溶液; B中装有铂石棉催化剂。点燃酒精灯一段时间后,将A中的H2O2溶液慢慢地滴入试管,试管内产生大量气体。不久,锥形瓶C内出现明显的颜色变化。回答下列问题:

(1)你认为反应中能催化分解H2O2的物质是(写化学式) 。
(2)试管中产生的气体是 。
(3)B中发生反应的化学方程式 。
(4)本实验还可以改用其他药品,例如在试管中加固体 ,胶头滴管预先吸入液体 。
(5)除干燥装置外,此实验装置的缺点是还缺少 装置。
查看习题详情和答案>>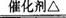
图1-4
(1)你认为反应中能催化分解H2O2的物质是(写化学式)__________________。
(2)试管中产生的气体是_________。
(3)B中发生反应的化学方程式为__________________。
(4)本实验还可以改用其他药品,例如在试管中加固体__________________,胶头滴管预先吸入液体_________。
(5)除干燥装置外,此实验装置的缺点是还缺少_________装置。
查看习题详情和答案>>