摘要:21.下图是几种中学常见的物质之间的转化关系.氧化物A是光导纤维的主要原料.Ⅰ.Ⅲ为非金属单质.Ⅱ为主族元素的金属单质. (1)氧化物A的化学式为 .写出氧化物A与NaOH溶液反应的化学方程式 , (2)向盐乙的水溶液中通入过量CO2.发生反应的离子方程式为 .向乙溶液中逐渐加入氯水能看到的实验现象为 . (3)单质Ⅰ的用途非常广泛.如用作 ,工业上制备单质Ⅰ的化学方程式为 . 解析:由已知得:A为SiO2.SiO2与NaOH反应生成盐甲(Na2SiO3)和氧化物C(H2O).在中学范围内常见的能与NaOH反应的非金属单质为Si.金属单质为Al.故单质Ⅰ为Si.与NaOH溶液反应生成Na2SiO3和单质Ⅲ(H2):Si+2NaOH+H2O===Na2SiO3+2H2↑.单质Ⅱ为Al.与NaOH反应生成盐乙(NaAlO2)和H2:2Al+2NaOH+2H2O===NaAlO2+3H2↑.推知氧化物B为Al2O3.因氯水中含有盐酸.所以氯水中逐渐加入NaAlO2溶液时首先生成白色沉淀.随着氯水的加入沉淀逐渐溶解.由于H2CO3的酸性大于Al(OH)3.向NaAlO2溶液中通入过量的CO2时.会生成白色沉淀Al(OH)3.其离子反应为:AlO+CO2+2H2O===Al(OH)3↓+HCO.工业上是利用SiO2在高温下与C反应来制备Si:SiO2+2C高温Si+2CO↑. 答案:(1)SiO2 SiO2+2NaOH===Na2SiO3+H2O (2)AlO+CO2+2H2O===Al(OH)3↓+HCO 产生白色沉淀.然后沉淀逐渐溶解至消失 (3)半导体材料 SiO2+2C高温Si+2CO↑
网址:http://m.1010jiajiao.com/timu3_id_84427[举报]
下图是几种中学常见的物质之间的转化关系,氧化物A是光导纤维的主要原料,Ⅰ、Ⅲ为非金属单质、Ⅱ为主族元素的金属单质.
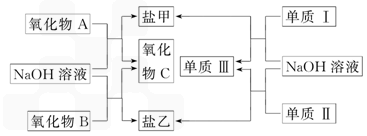
(1)氧化物A的化学式为________,写出氧化物A与NaOH溶液反应的化学方程式________________________________________;
(2)向盐乙的水溶液中通入过量CO2,发生反应的离子方程式为____________________,向乙溶液中逐渐加入氯水能看到的实验现象为____________________.
(3)单质Ⅰ的用途非常广泛,如用作________(只需写一种);工业上制备单质Ⅰ的化学方程式为_____________________________________.
查看习题详情和答案>>
(2)向盐乙的水溶液中通入过量CO2,发生反应的离子方程式为____________________,向乙溶液中逐渐加入氯水能看到的实验现象为____________________.
(3)单质Ⅰ的用途非常广泛,如用作________(只需写一种);工业上制备单质Ⅰ的化学方程式为_____________________________________.
下图是几种中学常见的物质之间的转化关系,氧化物A是光导纤维的主要原料,Ⅰ、Ⅲ为非金属单质,Ⅱ为主族元素的金属单质。
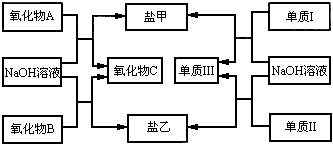
(1)写出氧化物A与NaOH溶液反应的化学方程式______________________;
(2)向盐乙的水溶液中通入过量CO2,观察到的现象是________________________,发生反应的离子方程式为_________________________。
(3)单质Ⅰ的用途非常广泛,如用做_________________(只需写一种);工业上制备单质Ⅰ的化学方程式为____________________________
查看习题详情和答案>>
(2)向盐乙的水溶液中通入过量CO2,观察到的现象是________________________,发生反应的离子方程式为_________________________。
(3)单质Ⅰ的用途非常广泛,如用做_________________(只需写一种);工业上制备单质Ⅰ的化学方程式为____________________________
下图是几种中学常见的物质之间的转化关系,氧化物A是光导纤维的主要原料,Ⅰ、Ⅲ为非金属单质,Ⅱ为主族元素的金属单质。
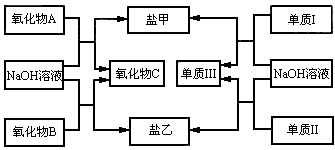
(1)写出氧化物A与NaOH溶液反应的化学方程式___________________________;
(2)向盐乙的水溶液中通入过量CO2,观察到的现象是________________________,发生反应的离子方程式为________________________。
(3)单质Ⅰ的用途非常广泛,如用做_____________(只需写一种);工业上制备单质Ⅰ的化学方程式为_______________________。
查看习题详情和答案>>
(2)向盐乙的水溶液中通入过量CO2,观察到的现象是________________________,发生反应的离子方程式为________________________。
(3)单质Ⅰ的用途非常广泛,如用做_____________(只需写一种);工业上制备单质Ⅰ的化学方程式为_______________________。
下图是几种中学常见的物质之间的转化关系,氧化物A是光导纤维的主要原料,Ⅰ、Ⅲ为非金属单质,Ⅱ为主族元素的金属单质.
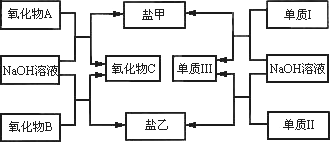
(1)氧化物A的化学式为________,写出氧化物A与NaOH溶液反应的化学方程式________;
(2)等物质的量的单质Ⅰ和单质Ⅱ分别与足量的氢氧化钠溶液反应,所得气体在相同状况下的体积比为________.
(3)单质Ⅰ的用途非常广泛,如用做________(只需写一种);工业上制备单质Ⅰ的化学方程式为________.
(8分)以海水中常见的物质A为原料可以发展很多种工业,下图中包含了几种基本工业生产,请根据各物质之间的转化关系
回答下列问题:
(1)C和D、C和G反应都可以制取消毒剂。C和G反应制取的消毒剂中有效成分的化学式为__________________________。
(2)若使工业合成J反应的化学平衡向生成J的方向移动,可采取的措施有_______________(填字母编号)。
A.升高温度 B.增大压强 C.使用催化剂 D.液化分离J
(3)将F和J通入A的饱和溶液中的顺序为_______________。
A.先通入F后通入J B.选通入J后通入F
C.同时通入 D.没有先后顺序要求
(4)图中所示工业制法获得的纯碱中常含有NaCl杂质,用下述方法可以测定样品中NaCl的质量分数。
①检验沉淀是否洗涤干净所用到的试剂是______________________,
②样品中NaCl的质量分数的数学表达式为__________________________。
查看习题详情和答案>>