13.水体中重金属铅的污染问题备受关注.水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)、Pb(OH),各形态的浓度分数α随浓度pH变化的关系如下图所示:

[1表示Pb2+,2表示Pb(OH)+,3表示Pb(OH)2,4表示Pb(OH),5表示Pb(OH)]
(1)Pb(NO3)2溶液中,________2( 填“>”“=” 或“<”);往该溶液中滴入氯化铵溶液后,增加,可能的原因是____________________.
(2)往Pb(NO3)2溶液中滴入稀NaOH溶液,pH=8时溶液中存在的阳离子(Na+除外)有________,pH=9时主要反应的离子方程式为____________________.
(3)某课题小组制备了一种新型脱铅剂,能有效去除水中的微量铅,实验结果如下表:
|
离子 |
Pb2+ |
Ca2+ |
Fe3+ |
Mn2+ |
Cl- |
|
处理前浓度/mg/L |
0.100 |
29.8 |
0.120 |
0.087 |
51.9 |
|
处理后浓度/mg/L |
0.004 |
22.6 |
0.040 |
0.053 |
49.8 |
上表中除Pb2+外,该脱铅剂对其他离子的去除效果最好的是________________.
(4)如果该脱铅剂(用EH表示)脱铅过程中主要发生的反应为:2EH(s)+Pb2+E2Pb(s)+2H+.
则脱铅的最合适pH范围为________(填代号).
A.4-5 B.6-7
C.9-10 D.11-12
解析:(1)Pb2+易水解,Pb2+与Cl-结合成微溶物PbCl2.
(2)根据图中曲线可看出在pH=8时溶液中铅元素除Pb2+和Pb(OH)+外,还有Pb(OH)2,但题目要求回答阳离子.
(3)要看去除效果的好坏不要只看处理后剩余的多少,也不能只看去除了多少,而应看去除的比率,除Pb2+外,当属Fe3+去除比率最高.
(4)据图观察和方程式判断,c(H+)过大,不利用沉淀生成,而c(OH-)过大Pb2+则会以其他形式存在,在pH=6时,c(Pb2+)最大,有利于平衡右移.
答案:(1)> Pb2+与Cl-反应,Pb2+浓度减小
(2)Pb2+、Pb(OH)+、H+ Pb(OH)++OH
 Pb(OH)2
Pb(OH)2
(3)Fe3+ (4)B
11.(2009·广东韶关月考)如下图所示,横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-的物质的量浓度的对数.
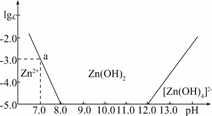
回答下列问题:
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为________________.
(2)从图中数据计算可得Zn(OH)2的溶度积Ksp=______________.
(3)某废液中含Zn2+,为提取Zn2+可以控制溶液中pH的范围是________.
(4)25℃时,PbCl2浓度随盐酸浓度变化如下表 :
|
c(HCl) (mol/L) |
0.50 |
1.00 |
2.04 |
2.90 |
4.02 |
5.16 |
5.78 |
|
103c(PbCl2) (mol/L) |
5.10 |
4.91 |
5.21 |
5.90 |
7.48 |
10.81 |
14.01 |
根据上表数据判断下列说法正确的是________.
A.随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大
B.PbCl2固体在0.50 mol/L盐酸中的溶解度小于在纯水中的溶解度
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(络合离子)
D.PbCl2固体可溶于饱和食盐水
解析:(1)向ZnCl2中加入足量NaOH溶液,即OH-过量,由图象知Zn2+与OH-最终生成[ZN(OH4)]2-.
(2)由Zn(OH)2(s)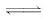
 Zn2+(aq)+2OH-(aq)
Zn2+(aq)+2OH-(aq)
知:Ksp[Zn(OH)2]=c(Zn2+)·[c(OH-)]2
将a点数据代入,可得:Ksp=(10-3)·(10-7)2=10-17
(3)由图象可知,当8.0<pH<12.0时,溶液中的Zn2+可与OH-结合为Zn(OH)2沉淀.
(4)由表知,开始PbCl2浓度由5.10降至4.91,又升至5.21,随后逐渐增大,故A正确.
 HCOO-+H3O+
HCOO-+H3O+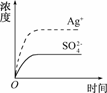 已知Ag2SO4的Ksp为2.0×10-5,将适量Ag2SO4固体溶于100 mL水中至刚好饱和,该过程中Ag+和SO浓度随时间变化关系如右图所示[饱和Ag2SO4溶液中c(Ag+)=0.034
mol/L].若t1时刻在上述体系中加入100 mL 0.020 mol/L Na2SO4溶液,下列示意图中,能正确表示t1时刻后Ag+和SO浓度随时间变化关系的是
已知Ag2SO4的Ksp为2.0×10-5,将适量Ag2SO4固体溶于100 mL水中至刚好饱和,该过程中Ag+和SO浓度随时间变化关系如右图所示[饱和Ag2SO4溶液中c(Ag+)=0.034
mol/L].若t1时刻在上述体系中加入100 mL 0.020 mol/L Na2SO4溶液,下列示意图中,能正确表示t1时刻后Ag+和SO浓度随时间变化关系的是