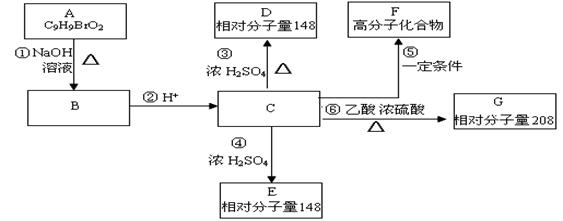
7. 某无色溶液中可能含有 ①Na+、②Ba2+、③Cl-、④Br-、⑤、SO42-⑥SO32-离子中的若干种,依顺序进行下列实验,且每步所加试剂均过量,观察到的现象如下:(绍兴一中2010期中考试20题改编)ww.k@s@5@ 高#考#资#源#网
|
步骤 |
操作 |
现象 |
|
1 |
用pH试纸检验 |
溶液的pH大于7 |
|
2 |
向溶液中滴加氯水,再加入CCl4振荡,静置 |
CCl4层呈橙色 |
|
3 |
向所得水溶液中加入Ba(NO3)2溶液和稀HNO3 |
有白色沉淀产生 |
|
4 |
过滤,向滤液中加入AgNO3溶液 |
有白色沉淀产生 |
下列结论正确的是
A.肯定含有的离子是①④⑥ B.不能确定的离子是①
C. 肯定没有的离子是②⑤ D.不能确定的离子是③⑤
第Ⅱ卷
4. 下列说法正确的是(原创)
A.在Na2O2晶体中阳离子与阴离子的物质的量之比为l:1
B.离子晶体中一定含有金属阳离子
C.水加热到很高的温度都难以分解是因为水分子间存在氢键
D.用鸡蛋壳内膜和蒸馏水可以除去淀粉胶体中的食盐
|
 A.用铜电极电解CuSO4溶液:2Cu2++2H2O 2Cu+4H++O2↑
A.用铜电极电解CuSO4溶液:2Cu2++2H2O 2Cu+4H++O2↑
B.硫酸氢钠溶液中加入氢氧化钡至溶液呈中性:H++SO42-+Ba2++OH-==BaSO4↓+H2O
C.硫酸亚铁酸性溶液中加入过氧化氢:2Fe2+ + H2O2 +2H+ = 2Fe3+ + 2H2O
D.向NaClO溶液中通入少量SO2:2ClOˉ+SO2+H2O=SO32ˉ+2HClO
10、(15分)(董君老师公开课 改编)补铁药物“速力菲”说明书部分内容摘录:
[规格]每片含琥珀酸亚铁0.1g
[组成与性状]内含Fe2+34.0%-36.0%的无水碱式盐,为薄膜糖衣片
[适应症]用于缺铁性贫血症预防及治疗
[用量用法]成人预防量0.1g/日,治疗量0.2g-0.4g/日;小儿预防量30-60mg/日,治疗量0.1g-0.3g/日
[储藏]在避光、密封、阴凉处保存
[药物相互作用]与维生素C同服,可增加本品吸收;该药片在水和乙醇中溶解度不大。
现某学校化学实验小组,为了检测“速力菲”药片中亚铁元素的存在,设计了如下几组实验:
Ⅰ、理论设计方案:ww.k@s@5@ 高#考#资#源#网
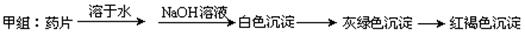 甲组同学按照设计的方案完成实验,但遗憾的是他们没有得到预期的实验结果,
甲组同学按照设计的方案完成实验,但遗憾的是他们没有得到预期的实验结果,
(1)甲组实验失败的可能原因: ▲ 。
乙组同学认真思考了甲组实验失败的原因,模拟药片服用后在人体中溶解的变化过程,重新设计并完成下列实验:

(2)若试剂1为盐酸;则试剂2为 ▲ 。加入试剂2后,溶液为什么显示淡红色? ▲
加入双氧水溶液后,为什么红色加深? ▲
丙组同学对乙组实验中最后红色褪去的现象产生了研究兴趣,探讨褪色的原因,根据微粒的组成,他们认为有两种可能的原因:
① [Fe(SCN)]2+络离子中的三价铁被还原为亚铁
② ▲
(3)请你对其中一种可能进行实验验证:
实验方案(用文字叙述): ▲ ,根据预期现象判断结论: ▲
Ⅱ、(4)称量“速力菲”1.0 g,将其全部溶于稀硫酸中,配制成100.00 mL溶液,取出20.00 mL,用0.01000 mol/L的KMnO4溶液滴定。三次操作读数如下:
|
序号 |
V(KMnO4)初 |
V(KMnO4)终 |
V(KMnO4) |
|
1 |
2.24mL |
14.25mL |
12.01mL |
|
2 |
0.30mL |
12.72mL |
12.42mL |
|
3 |
0.50mL |
12.53 |
12.03mL |
计算:该补血药中含Fe2+的质量分数 ▲ (保留小数点后二位小数)。
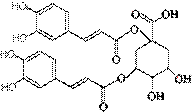 洋蓟素是一种新结构类型的抗乙型肝炎病毒和抗艾滋病病毒的化合物, 其结构如下图所示,有关洋蓟素的说法正确的是(连四个不同基团的碳属于手性碳)(2010四川成都高考模拟6题改编)
洋蓟素是一种新结构类型的抗乙型肝炎病毒和抗艾滋病病毒的化合物, 其结构如下图所示,有关洋蓟素的说法正确的是(连四个不同基团的碳属于手性碳)(2010四川成都高考模拟6题改编)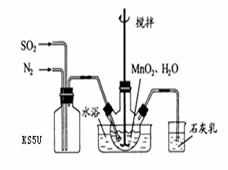 在烧瓶中(装置见右图)加入一定量MnO2和水,搅拌,通入 SO2和N2混合气体,反应3h。停止通入SO2,继续反应片刻,过滤(已知
在烧瓶中(装置见右图)加入一定量MnO2和水,搅拌,通入 SO2和N2混合气体,反应3h。停止通入SO2,继续反应片刻,过滤(已知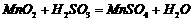 )。
)。 ②若实验中将
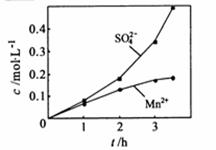
②若实验中将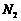 换成空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如右图。导致溶液中Mn2+、SO42-浓度变化产生明显差异的原因是
。
换成空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如右图。导致溶液中Mn2+、SO42-浓度变化产生明显差异的原因是
。