摘要:[改编浙江省新高考研究联盟2011届第一次联考] Ⅰ高纯MnCO3是制备高性能磁性材料的主要原料.ww.k@s@5@ 高#考#资#源#网 实验室以MnO2为原料制备少量高纯MnCO3 的操作步骤如下: (1)制备MnSO4溶液: 在烧瓶中加入一定量MnO2和水.搅拌.通入 SO2和N2混合气体.反应3h.停止通入SO2.继续反应片刻.过滤(已知). ①石灰乳作用 . ②若实验中将换成空气.测得反应液中Mn2+.SO42-的浓度随反应时间t变化如右图.导致溶液中Mn2+.SO42-浓度变化产生明显差异的原因是 . (2)制备高纯MnCO3固体:已知MnCO3难溶于水.乙醇.潮湿时易被空气氧化.100℃开始分解,Mn(OH)2开始沉淀时pH=7.7, 请补充由(1)制得的MnSO4溶液制备高纯MnCO3的操作步骤[实验中可选用的试剂:Ca(OH)2.NaHCO3.Na2CO3.C2H5OH]. ① ,② ,③检验SO42-是否被洗涤除去,④ ,⑤低于100℃干燥. Ⅱ 锌铝合金的主要成分有Zn.Al.Cu.Si等元素.实验室测定其中Cu含量的步骤如下:①称取该合金样品1.1g.用HCl和H2O2溶解后.煮沸除去过量H2O2.过滤.滤液定容于250mL容量瓶中. ②用移液管移取50.00mL滤液于250mL碘量瓶中.控制溶液的pH=3-4.加入过量KI溶液(生成CuI和I2)和指示剂.用0.01100mol×L-1Na2S2O3溶液滴定生成的I2至终点(反应:I2 + 2S2O32- = 2I- + S4O62-).消耗Na2S2O3溶液6.45mL. (1)判断步骤②滴定终点的方法是 . (2)计算合金中Cu的质量分数 . [改编2011萧山中学三月月考]11.芳香族化合物A(化学式为(C9H9BrO2)在一定条件下有如下的转化关系.其中1mol C与Na完全反应生成1 mol H2.若与NaHCO3完全反应也能产生1mol CO2.D和E互为同分异构体.但D可以使溴的四氯化碳溶液褪色.而E分子中有一个苯环和一个五元环. (1)C的分子式 . A.D.G的结构简式A .D .G , (2)用核磁共振氢谱可以证明化合物B中有 种氢处于不同的化学环境. (3)反应⑤的化学方程式 , 已知R物质属于C的同分异构体.其性质如下: (4)若R的苯环上一卤代物有两种.R的结构简式为 , (5)若R的苯环上一卤代物有三种.R的结构简式 . ww.k@s@5@ 高#考#资#源#网
网址:http://m.1010jiajiao.com/timu3_id_432953[举报]
科学家一直致力于“人工固氮”的新方法研究.
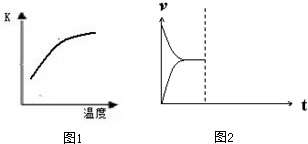
(1)最新“人工固氮”的研究报道:常温常压、光照条件下,N2在催化剂表面与水发生反应:
2N2(g)+6H2O(l)?4NH3 (g)+3O2(g)+Q
已知该反应的平衡常数K与温度的关系如图1,则此反应的 Q 0 (填“>”“<”或“=”).
(2)常温下,如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时, (选填编号).
A.容器中气体的平均分子量不随时间而变化 B. v(N2)/v(O2)=2:3
C.容器中气体的密度不随时间而变化 D.通入稀有气体能提高反应的速率
(3)将反应生成的混合气体通入水中即可得氨水.用水稀释0.1mol?L-1氨水,溶液中随着水量的增加而增大的是 (填字母标号).
A.c(H+)×c(NH3?H2O)/c(OH-) B.c(NH4+)×c(OH-)/c(NH3?H2O)
C.c(H+)?c(OH-) D.
(4)常温下,在恒压密闭容器中上述反应达到平衡后,在其他条件不变时,通入2mol N2,请在图2中画出正(v正)、逆(v逆)反应速率随时间t变化的示意图.
查看习题详情和答案>>

(1)最新“人工固氮”的研究报道:常温常压、光照条件下,N2在催化剂表面与水发生反应:
2N2(g)+6H2O(l)?4NH3 (g)+3O2(g)+Q
已知该反应的平衡常数K与温度的关系如图1,则此反应的 Q
(2)常温下,如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,
A.容器中气体的平均分子量不随时间而变化 B. v(N2)/v(O2)=2:3
C.容器中气体的密度不随时间而变化 D.通入稀有气体能提高反应的速率
(3)将反应生成的混合气体通入水中即可得氨水.用水稀释0.1mol?L-1氨水,溶液中随着水量的增加而增大的是
A.c(H+)×c(NH3?H2O)/c(OH-) B.c(NH4+)×c(OH-)/c(NH3?H2O)
C.c(H+)?c(OH-) D.
| C(H+) | C(OH-) |
(4)常温下,在恒压密闭容器中上述反应达到平衡后,在其他条件不变时,通入2mol N2,请在图2中画出正(v正)、逆(v逆)反应速率随时间t变化的示意图.
 (2010?聊城二模)I.科学家一直致力于“人工固氮”的新方法研究.
(2010?聊城二模)I.科学家一直致力于“人工固氮”的新方法研究.(l)目前合成氨技术原理为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
如图表示工业合成氨反应在某一段时间中反应速率与反应过程的关系曲线图:
①氢化物的体积分数最高的一段时间为
t0~t1
t0~t1
;t1时刻改变的反应条件是升温
升温
.②NH3极易溶于水,其水溶液俗称氨水.用水稀释0.1mol/L的氨水,溶液中随着水量的增加而减小的是
bd
bd
(填序号).a.
| c(NH4+)?c(OH-) |
| c(NH3?H2O) |
| c(NH3?H2O) |
| c(OH-) |
| c(OH-) |
| c(H+) |
(2)1998年希腊亚里士多德大学的两位科学家采用高质子导电性的SCY冉瓷(能传递H+),实现了高温常压下利用
N2和H2电解合成氨.其阴极的电极反应式
N2+6H++6e-=2NH3
N2+6H++6e-=2NH3
.(3)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:2N2(g)+6H2O(1)?4NH3(g)+3O2(g)△H=akJ/mol 进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
>
>
0,△S>
>
0,(填“>”“<”或“=”).②已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol;2H2(g)+O2(g)=2H2O(g)△H=-571.6kJ/mol 则2N2(g)+6H2O(g)=4NH3(g)+3O2(g)△H=
+l530kJ/mol
+l530kJ/mol
.科学家一直致力于“人工固氮”的新方法研究.据报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3和O2.
(1)已知:①H2(g)+
O2(g)═H2O(l)△Hl=-285.6kJ/mol
②N2(g)+3H2(g)?2NH3(g)△H2=-92.2kJ/mol
写出此条件下氮气和水反应的热化学方程式 .
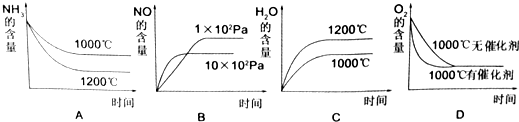
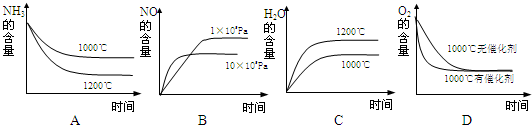
(2)氨可用于工业制硝酸,其主反应为:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0,此反应的化学平衡常数表达式为 ,若此反应起始的物质的量相同,则如图所示的关系图正确的是 (填序号)
在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
①反应在第2min到第4min时,O2的平均反应速率为 mol?L-1?min-1.
②反应在第2min时改变了条件,改变的条件可能是 .
③在第6min时,改变了反应的条件,该平衡向 移动(填“左”或“右”).
查看习题详情和答案>>
(1)已知:①H2(g)+
| 1 |
| 2 |
②N2(g)+3H2(g)?2NH3(g)△H2=-92.2kJ/mol
写出此条件下氮气和水反应的热化学方程式
(2)氨可用于工业制硝酸,其主反应为:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0,此反应的化学平衡常数表达式为

在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
| 时间/浓度 | c(NH3)(mol/L) | c(O2)(mol/L) | c(NO)(mol/L) |
| 起始 | 0.8000 | 1.600 | 0.000 |
| 第2min | 0.6000 | a | 0.2000 |
| 第4min | 0.3000 | 0.9750 | 0.5000 |
| 第6min | 0.3000 | 0.9750 | 0.5000 |
| 第8min | 0.7000 | 1.475 | 0.1000 |
②反应在第2min时改变了条件,改变的条件可能是
③在第6min时,改变了反应的条件,该平衡向
科学家一直致力于“人工固氮”的新方法研究.最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂表面与水发生下列反应:
2N2(g)+6H2O(l) 4NH3 (g)+3O2(g)△H=a kJ?mol-1
4NH3 (g)+3O2(g)△H=a kJ?mol-1
上述反应NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
(1)此合成反应的a
(2)用水稀释0.1mol?L-1氨水,溶液中随着水量的增加而减小的是
A.
B.
C.c(H+)?c(OH-) D.
(3)氨可用于工业制硝酸,其主反应为:
4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H<0
若此反应起始的物质的量相同,则下列关系图正确的是
(4)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
①反应在第2min到第4min时,O2 的平均反应速率为
②反应在第2min到第4min时改变了条件,改变的条件可能是
③在第6min到第8min时,改变了反应的条件,该平衡向
查看习题详情和答案>>
2N2(g)+6H2O(l)
 4NH3 (g)+3O2(g)△H=a kJ?mol-1
4NH3 (g)+3O2(g)△H=a kJ?mol-1上述反应NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
| 温度 T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
>
>
0 (填“>”“<”或“=”)(2)用水稀释0.1mol?L-1氨水,溶液中随着水量的增加而减小的是
AD
AD
(填字母标号)A.
| c(NH3?H2O) |
| c(OH-) |
| c(NH4+)?c(OH-) |
| c(NH3?H2O) |
| c(OH-) |
| c(H+) |
(3)氨可用于工业制硝酸,其主反应为:
4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H<0
若此反应起始的物质的量相同,则下列关系图正确的是
BD
BD
(填序号)
(4)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
| 时间/浓度 | c(NH3) (mol/L) | c(O2 ) (mol/L) | c(NO) (mol/L) |
| 起始 | 0.8000 | 1.600 | 0.000 |
| 第2min | 0.6000 | a | 0.2000 |
| 第4min | 0.3000 | 0.9750 | 0.5000 |
| 第6min | 0.3000 | 0.9750 | 0.5000 |
| 第8min | 0.7000 | 1.475 | 0.1000 |
0.1875
0.1875
mol/(L?min)②反应在第2min到第4min时改变了条件,改变的条件可能是
升高温度或使用催化剂
升高温度或使用催化剂
.③在第6min到第8min时,改变了反应的条件,该平衡向
左
左
移动(填“左”或“右”).科学家一直致力于“人工固氨”的新方法研究.目前合成氨技术原理为:
N2(g)+3H2(g)?2NH3(g)+92.4kJ/mol
673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图1所示.
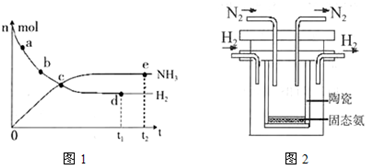
(1)下列叙述正确的是
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d和点e处的n (N2)相同
D.773K,30MPa 下,反应至t2时刻达到平衡,则n(NH3)比图中e点的值大
(2)在容积为2.0L恒容得密闭容器中充入0.80mol N2(g)和1.60mol H2(g),673K、30MPa下达到平衡时,NH3的体积分数为20%.该条件下,N2(g)+3H2(g)?2NH3(g)的平衡常数值为:
(3)K值越大,表明反应达到平衡时
A.H2的转化率一定越高 B.NH3的产量一定越大 C.正反应进行得越完全 D.化学反应速率越大
(4)1998年希腊亚里斯多德大学的两位科学家采用高质子导电性的SCY陶瓷(能传递H+),实现了高温、常压下高转化率的电解合成氨.其实验装置如图2.阳极的电极反应为:H2-2e→2H+,则阴极的电极反应为:
查看习题详情和答案>>
N2(g)+3H2(g)?2NH3(g)+92.4kJ/mol
673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如图1所示.

(1)下列叙述正确的是
AC
AC
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d和点e处的n (N2)相同
D.773K,30MPa 下,反应至t2时刻达到平衡,则n(NH3)比图中e点的值大
(2)在容积为2.0L恒容得密闭容器中充入0.80mol N2(g)和1.60mol H2(g),673K、30MPa下达到平衡时,NH3的体积分数为20%.该条件下,N2(g)+3H2(g)?2NH3(g)的平衡常数值为:
1.07
1.07
.(3)K值越大,表明反应达到平衡时
C
C
.A.H2的转化率一定越高 B.NH3的产量一定越大 C.正反应进行得越完全 D.化学反应速率越大
(4)1998年希腊亚里斯多德大学的两位科学家采用高质子导电性的SCY陶瓷(能传递H+),实现了高温、常压下高转化率的电解合成氨.其实验装置如图2.阳极的电极反应为:H2-2e→2H+,则阴极的电极反应为:
N2+6H++6e-=2NH3
N2+6H++6e-=2NH3
.