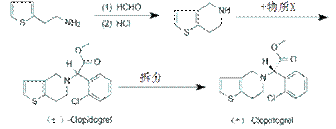9、(15分)(2011年浙江省学军等三校高三联考理科综合试卷 改编)相同温度下,在四个密闭容器中发生可逆反应:H2(g)+I2(g) 2HI(g),实验测得起始、平衡时的有关数据如下表所示:
2HI(g),实验测得起始、平衡时的有关数据如下表所示:
|
容器编号 |
起始时各物质的物质的量(mol) |
达平衡时体系的变化 |
||
|
I2 |
H2 |
HI |
||
|
① |
1 |
3 |
0 |
放出热量:Q1=23.15kJ |
|
② |
0.8 |
2.8 |
0.4 |
平衡时碘化氢的体积分数为20% |
|
③ |
0 |
4 |
4 |
|
|
④ |
2 |
3 |
0 |
|
(1)下列叙述正确的是 ▲
A.四个容器中反应的平衡常数相等
B.反应的热化学方程式为:H2(g)+I2(g) 2HI(g) △ H =23.15kJ/mol
2HI(g) △ H =23.15kJ/mol
C.平衡时,容器④中H2的转化率高于① D、容器②中达平衡时放出的热量Q2<23.15kJ
E、达到平衡后若将容器①的体积变为0.25 L,H2的转化率提高
(2)该温度下,在容积为1L密闭容器③中发生反应建立平衡,若达到平衡所需的时间为2min,则平均反应速率v(HI)= ▲ ,该温度下,反应H2(g)+I2(g) 2HI(g)的平衡常数 K= ▲ 。
2HI(g)的平衡常数 K= ▲ 。
(3)平衡常数K只受温度的影响,与浓度、压强等因素无关,故可利用平衡常数来判断平衡是否移动及移动的方向。例如,若③为一个装有可移动活塞的容器,上述平衡达成后用外力将活塞向内推至容积为0.5L并恢复原温度,则由于
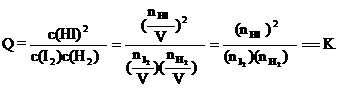 ,
,
可判断平衡将 ▲ (填“正向”、“逆向”或“不”)移动。
(4)如果保持温度和压强不变,向③的平衡体系中加入1.6molI2,平衡将 ▲ (填“正向”、“逆向”或“不”)移动,理由是 ▲ 。
3、(2011年三月浙江金华、丽水、衢州十二校联考 改编)下列离子方程式的评价正确的是
|
化学用语 |
评价 |
|
A.在碳酸氢镁溶液中加入过量氢氢化钠溶液:Mg2++2HCO3-+2OH-=Mg CO3↓+CO32-+2H2O |
错误:生成物应是Mg(OH)2和Na2CO3 |
|
B.在亚硫酸氢钠中加入少量的次氯酸钠溶液 SO32-+ClO-+H2O= Cl-+2H++SO42- |
正确 |
|
C. 亚磷酸是一种二元酸,在其中加入过量的烧碱溶液:H3PO3+3OH-=PO33-+3H2O |
正确 |
|
D.在过氧化钠中加入稀硫酸: N a2O 2+2H+=2Na++H2O+O2↑ |
正确 |
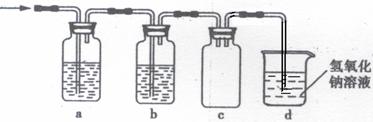
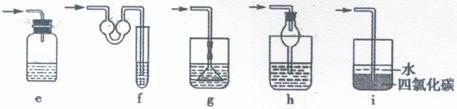
ww.k@s@5@ 高#考#资#源#网4、(原创)下列实验操作能够实现的是
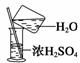
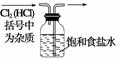
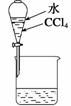
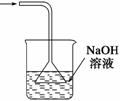
A、浓硫酸的稀释 B、除去氯气中的杂质 C、分离水和四氯化碳D、吸收氯化氢尾气
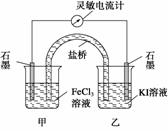 (2009·福建理综,11改编) 将反应2Fe3++2I-
(2009·福建理综,11改编) 将反应2Fe3++2I-
 2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是
2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是 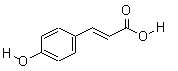 (原创)对羟基肉桂酸是一种强效的导电材料,在液晶显示器工业中近年来研究广泛。结构简式如图,下列说法不正确的是
(原创)对羟基肉桂酸是一种强效的导电材料,在液晶显示器工业中近年来研究广泛。结构简式如图,下列说法不正确的是
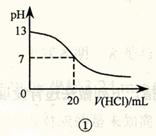 (原创)下列溶液说法正确的是
(原创)下列溶液说法正确的是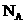 表示阿伏伽德罗常数,下列判断正确的是
表示阿伏伽德罗常数,下列判断正确的是 溶液中铵根离子为0.1
溶液中铵根离子为0.1
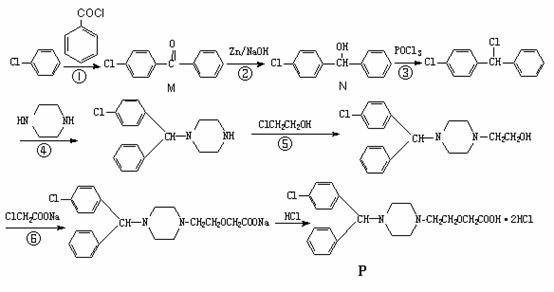
 )结构。
)结构。