①置换反应都是氧化还原反应;②复分解反应都不是氧化还原反应;③有单质生成的分解反应是氧化还原反应;④有单质参加的化合反应也是氧化还原反应。
从数学集合角度考虑:
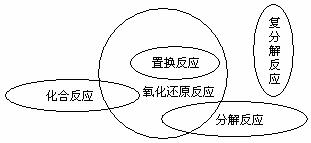
[要点透析]
1.氧化还原反应的判断方法
凡是有元素化合价升降的化学反应就是氧化还原反应。判断的依据就是寻找整个反应过程是否有元素化合价在反应前后发生变化。
|
2、氧化--还原中的基本规律: 电子得失相等:对于一个完整的氧化--还原反应,氧化剂得到的电子总数与还原剂失去的电子总数相等。 |
化合价升降相等:在氧化--还原反应中,氧化剂化合价降低的总数一定等于还原剂化合价升高的总数。
3.常见的氧化剂
(1)活泼的非金属单质:Cl2、Br2、O2等
(2)含高价金属阳离子的化合物:FeCl3、CuCl2、AgNO3等
(3)含有较高化合价元素的化合物:H2SO4、HNO3、KMnO4、K2Cr2O3、MnO2、HClO4、HClO3、HClO等
4.常见的还原剂
(1)活泼成较活泼的金属:K、Na、Al、Mg、Zn等
(2)含低价金属阳离子的化合物:FeCl2
(3)某些非金属单质:C、H2、Sr、P等
(4)含有较低化合价元素的化合物:HCl、Na2S、KI、NH3、CO、SO2、Na2SO3等在含可变价元素的化合物中,具有中间价态元素的物质(单质成化合物)既可做氧化剂,又可做还原剂。如Cl2、SO2、S、H2O2等既具有氧化性、又具有还原性。学习中应注意:氧化剂和还原剂的确定要以实际反应为依据,是相对而言的,同一物质在不同条件下,不同反应中,可以作还原剂,也可以作氧化剂。如:

(还原剂)(氧化剂)
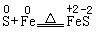
(氧化剂)(还原剂)
还有一些物质,在同一反应中既是氧化剂又是还原剂。如
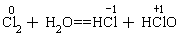
(氧化剂、 还原剂)
因此对规律性的知识既不能生搬硬套,也不能死记硬背,灵活掌握知识,以辩证的观点去看待问题、解决问题。
5、氧化性还原性强弱判断
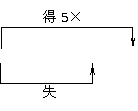
(1)单线桥法。从被氧化(失电子,化合价升高)的元素指向被还原(得电子,化合价降低)的元素,标明电子数目,不需注明得失。例:

MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(2)双线桥法。得失电子分开注明,从反应物指向生成物(同种元素)注明得失及电子数。例:
|
 MnO2+4HCl(浓)
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
 注意两类特殊的化学反应。①歧化反应,同种元素同价态在反应中部分原子化合价升高,部分原子化合价降低。例:
注意两类特殊的化学反应。①歧化反应,同种元素同价态在反应中部分原子化合价升高,部分原子化合价降低。例:
3Cl2+6KOH KClO3+5KCl+3H2O
KClO3+5KCl+3H2O
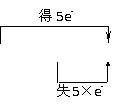 ②归中反应。不同价态的同种元素的原子在反应中趋于中间价态,解此类题最好将该元素的不同价态用数轴标出,变化的区域只靠拢,不重叠。例:
②归中反应。不同价态的同种元素的原子在反应中趋于中间价态,解此类题最好将该元素的不同价态用数轴标出,变化的区域只靠拢,不重叠。例:
KClO3+6HCl 3Cl2+ 6KCl↑ +3H2O
3Cl2+ 6KCl↑ +3H2O
 有氧化性
有氧化性 溶液和20mL氨水分别与0.10mol/L的盐酸反应,若恰好反应时都消耗盐酸20mL,则原来的
溶液和20mL氨水分别与0.10mol/L的盐酸反应,若恰好反应时都消耗盐酸20mL,则原来的 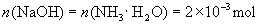
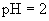 的强酸溶液与
的强酸溶液与
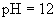 的强碱溶液等体积混合后,所得溶液的pH等于7”。判断在室温条件下,如下的两种酸碱溶液相混合,pH肯定大于7的是( )
的强碱溶液等体积混合后,所得溶液的pH等于7”。判断在室温条件下,如下的两种酸碱溶液相混合,pH肯定大于7的是( )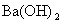 溶液等体积混合
溶液等体积混合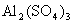 溶液中水的电离度为
溶液中水的电离度为
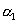 ,pH等于11的
,pH等于11的 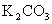 溶液中水的电离度为
溶液中水的电离度为
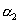 ,则
,则
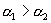 B.
B. 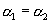 C.
C. 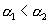 D.不一定
D.不一定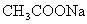 ,②
,②
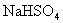 ,③
,③
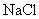 ,④
,④
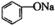 。按pH由大到小的顺序排列正确的是( )
。按pH由大到小的顺序排列正确的是( )