25.(15分)由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、 、Mg2+、Ba2+、CI-、
、Mg2+、Ba2+、CI-、 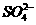 、
、 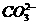 。将该混合物溶于水后得澄清溶液.现取3份l00mL该溶液分别进行如下实验:^S*
。将该混合物溶于水后得澄清溶液.现取3份l00mL该溶液分别进行如下实验:^S*
|
试验序号 |
|
试验内容 |
试验结果 |
|
||||
|
1 |
|
加AgNO3溶液 |
有白色沉淀生成 |
|
||||
|
2 |
|
加足量NaOH溶液并加热 |
收集到气体1.12L(已折算成 |
|
||||
|
|
|
|
|
标准状况下的体积) |
|
|||
|
3 |
|
加足量BaCl2溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然 后干燥、称量 |
|
第一次称量读数为6.27g,第 二次称量读数为2.33g |
|
|||
|
|
|
|
|
|||||
|
|
||||||||
试回答下列问题:
(1)根据实验1对Cl-是否存在的判断是 (填“一定存在”、“一定不存在”或“不能确定”);根据实验l-3判断混合物中一定不存在的离子是
。
(2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满):
|
阴离子符号 |
|
物质的量浓度(mo1·L-) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(3)试确定K- 是否存在? ,判断的理由是
选考部分
23.(14分)铜在自然界存在于多种矿石中,如黄铜矿(CuFeS2)、辉铜矿(Cu2S)、孔雀石(CuCO3·Cu(OH)2)等。
(1)黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,由黄铜矿冶炼铜的反应为:8 CuFeS2+21O2=8Cu+4FeO+2Fe2O3+16 SO2
① 在反应产物中加入过量的盐酸溶解,其溶液中含有的阳离子为 。
② 上述冶炼过程产生大量的SO2。某实验小组欲探究二氧化硫的化学性质,设计如下实验,请完成实验报告
|
序号 |
|
二氧化硫的性质 |
|
主要操作和现象 |
化学方程式 |
|||
|
Ⅰ |
|
|
|
将二氧化硫通入装有品红溶液的试管中,品红由红色变为无色 |
|
|||
|
Ⅱ |
|
氧化性 |
|
|
|
|||
|
Ⅲ |
|
|
|
将二氧化硫通入装有新制氯水的试管中,氯水由浅黄绿色色变为无色 |
|
|||
|
|
|
|
|
|
||||
(2)孔雀石在一定条件F能发生分解反应,其产物有如下转化关系。E为相对分子质量为44且能和新制的氢氧化铜在加热下反应的化合物
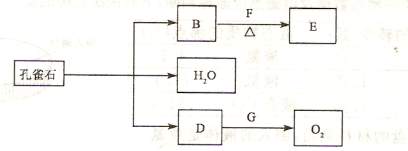
① D跟G反应的化学方程式为: :
② B和F反应的化学方程式为: .


 (2)配合物
分子内的作用力有 (填编号)。
(2)配合物
分子内的作用力有 (填编号)。
 ①CH2=CH2、②CH≡CH、③
、④HCHO等,
①CH2=CH2、②CH≡CH、③
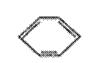
、④HCHO等,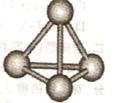 (3)最近意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的C4分子。C4分子结构如右图所示,已知断裂lmolC-C吸收167kJ热量,生成Imo1C=C放出942kJ热量
(3)最近意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的C4分子。C4分子结构如右图所示,已知断裂lmolC-C吸收167kJ热量,生成Imo1C=C放出942kJ热量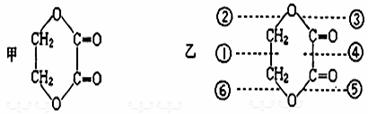
 H++C1-+HC1O,若向氯水中加入少量Na2CO3粉末,溶液中发生的变化是( )
H++C1-+HC1O,若向氯水中加入少量Na2CO3粉末,溶液中发生的变化是( ) 2H2↑+O2↑
2H2↑+O2↑ CH3COO-+NH4++2Ag↓+3NH3+H2O
CH3COO-+NH4++2Ag↓+3NH3+H2O