网址:http://m.1010jiajiao.com/timu3_id_419569[举报]
(1)用单线桥法标出电子得失的方向和数目


(2)上述反应中氧化剂是
| 3 |
| 4 |
| 3 |
| 4 |
(1)该氧化还原反应中,被氧化的元素是
(2)将以上物质分别填入下面对应的横线上,组成一个未配平的化学方程式.
(3)请将氧化剂、还原剂的化学式及配平后的系数填入下列相应的位置中,并用单线桥法标出电子转移的方向和数目.
□-----+□------.
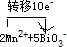
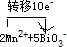
(1)该氧化还原反应中,被氧化的元素是 ,氧化剂是 ;
(2)将以上物质分别填入下面对应的横线上,组成一个未配平的化学方程式.
+ + → + +H2O
(3)请将氧化剂、还原剂的化学式及配平后的系数填入下列相应的位置中,并用单线桥法标出电子转移的方向和数目.
□-----+□------. . 查看习题详情和答案>>
氧化还原反应在生产和生活中使用非常广泛。
I(4分)、一个体重50 kg的健康人含铁2 g,这2 g铁在人体中不是以金属单质的形式存在,而是以Fe2+和Fe3+的形式存在。亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于铁的吸收。
(1)以下为常见的铁元素的几种微粒,其中既有氧化性又有还原性的是__________。
A. Fe B. Fe2+ C. Fe3+
(2)工业盐的主要成分是NaNO2,以前有许多起因误食NaNO2而中毒的事件,其原因是NaNO2把人体内的Fe2+转化为Fe3+而失去与O2结合的能力,这说明NaNO2具有________性。下列也能实现这种转化的物质是________。
A. Cl2 B. O2 C. FeCl3 D.浓硫酸
(3)工业盐中毒后,可服用维生素C来缓解中毒状况,这说明维生素C具有________性。
II(8分)、某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。(As——砷)
![]() (1)已知KBrO3中的溴元素在反应中得到电子,则该反应的还原剂是 。
(1)已知KBrO3中的溴元素在反应中得到电子,则该反应的还原剂是 。
![]() (2)已知0.2molKBrO3在反应中得到1mol电子生成X,则X中Br的化合价为 。
(2)已知0.2molKBrO3在反应中得到1mol电子生成X,则X中Br的化合价为 。
![]() (3)根据上述反应可推知 。
(3)根据上述反应可推知 。
![]() a.氧化性:
a.氧化性:![]() b.氧化性:
b.氧化性:![]()
![]() c.还原性:
c.还原性:![]() d.还原性:
d.还原性:![]()
![]() (4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并用单线桥法标出电子转移的方
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并用单线桥法标出电子转移的方![]() 向和数目:
向和数目: